帕金森新药!住友制药新型阿扑吗啡舌下膜剂APL-130277在美进入审查,快速按需治疗各类OFF事件!
来源:本站原创 2019-12-28 08:32
2019年12月27日讯 /生物谷BIOON/ --日本住友制药美国子公司Sunovion Pharma公司近日宣布,美国食品和药物管理局(FDA)已受理阿扑吗啡舌下膜剂(apomorphine sublingual film,APL-130277)的新药申请(NDA),用于治疗帕金森病(PD)患者经历的运动症状波动(motor fluctuations,即

2019年12月27日讯 /生物谷BIOON/ --日本住友制药美国子公司Sunovion Pharma公司近日宣布,美国食品和药物管理局(FDA)已受理阿扑吗啡舌下膜剂(apomorphine sublingual film,APL-130277)的新药申请(NDA),用于治疗帕金森病(PD)患者经历的运动症状波动(motor fluctuations,即:OFF episodes,“OFF”事件)。该NDA于今年11月21日重新提交,FDA已指定处方药用户收费法(PDUFA)目标日期为2020年5月21日。APL-130277在2016年8月,FDA授予了APL-130277快速通道地位。
值得一提的是,今年1月底,FDA发布了一封完整回应函(CRL),拒绝批准APL-130277。当时,FDA在CRL中表示,在对该药的NDA进行审查后,认定以目前的NDA数据无法批准APL-130277,需要提供额外的信息和分析,但不需要开展新的临床研究。此次重新提交的NDA中,包括了关于拟包装的信息以及临床数据的额外分析。
PD是一种慢性、进行性、神经退行性疾病,主要运动症状表现为静止时震颤、僵硬和运动受损,非运动症状包括认知障碍和情绪障碍。PD是仅次于阿尔茨海默病(AD)的第二常见神经退行性疾病,随着人口老龄化,PD的患病率正在逐步升高。目前,口服左旋多巴是治疗PD的“金标准”,患者群体中服用该药的比例高达75%。
OFF事件(OFF episodes)是指在药物控制的情况下,PD症状的恶化或重新出现,包括运动和非运动症状。OFF事件可能在一天中的任何时间发作,通常是早晨醒来后,并在一天内定期发作。OFF事件发作的特征是震颤、僵硬或行动缓慢,会扰乱患者进行日常活动的能力,给患者、家属和看护者造成沉重的负担。据估计,有多达40%-60%的PD患者会出现OFF事件,其发作频率和严重程度会在疾病进展过程中恶化。这些患者急需一种新的药物来有效控制OFF事件的发作。
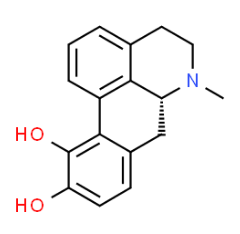
apomorphine(图片来源:chemspider.com)
APL-130277是一种新剂型的阿扑吗啡(apomorphine),后者是一种多巴胺D2受体激动剂,用作OFF事件的急救药品,在美国批准的剂型为皮下注射液。APL-130277是一种舌下膜剂,通过简单的舌下含服给药。
目前,APL-130277正被开发作为一种速效药物,用于所有类型“OFF”事件的按需治疗,包括清晨OFF事件、不可预测的OFF事件、剂末效应OFF事件。APL-130277舌下含服的给药方式不仅解决了皮下注射所带来的各种问题,而且还能更加迅速地稳定帕金森症的“OFF”症状,安全性也大幅提高。
Sunovion公司执行副总裁兼首席医疗官、住友制药集团全球临床开发主管Antony Loebel医学博士表示:“OFF是帕金森病常见且具有挑战性的一部分,现有的治疗方案很少。OFF发作的不可预测性会对帕金森病患者及其护理人员的日常生活造成极大的挑战和破坏。我们期待着在余下的审查期内与FDA合作,为PD患者带来急需的OFF事件按需治疗方案。”
迈克尔·J·福克斯帕金森氏症研究基金会(MJFF)首席执行官Todd Sherer博士表示:“帕金森症患者也有同样的看法,即OFF事件会破坏其生活质量。新的治疗方法可能意味着更多的人能更好地控制症状,提高他们驾驭日常生活的能力和信心。”
帕金森治疗方面,近年来已有数款药物获批上市,包括:(1)Acorda公司的药物-设备Inbrija,用于接受卡比多巴/左旋多巴治疗的PD患者“OFF”事件的间歇性治疗,这是首个吸入性左旋多巴产品,由患者自己手持操作给药。(2)协和麒麟的Nourianz(istradefylline片剂),作为左旋多巴/卡比多巴的附加疗法,用于正在经历OFF事件的PD成人患者,该产品从最初被FDA拒绝批准到最终获得批准,前后经历了长达十一年之久。(3)卫材/明治的Xadago/Equfina(safinamide),该药是一种新型选择性MAO-B抑制剂,用于正在接受一种含左旋多巴药物治疗的帕金森病患者,改善疗效减退现象(wearing-off phenomenon)。
今年7月,Neurocrine Biosciences公司药物opicapone的新药申请(NDA)获美国FDA受理,该药是一种新型、每日一次、口服选择性儿茶酚-O-甲基转移酶(COMT)抑制剂,作为左旋多巴/卡比多巴的一种辅助疗法,用于正在经历运动波动(OFF事件)的帕金森病患者。FDA已指定该NDA的处方药用户收费法(PDUFA)目标日期为2020年4月26日。如果获得批准,opicapone将提供一种新的治疗方案来延长左旋多巴的疗效。
Neurocrine Biosciences公司在2017年从葡萄牙制药公司BIAL授权获得opicapone在美国和加拿大的独家开发和商业化权利。在欧盟,这款药物已于2016年6月获得批准,商品名为Ongentys。
2018年1月,复星医药以1800万美元从BIAL公司授权获得了opicapone在中国市场的独家权利,其中包括一笔300万美元首付款和高达1500万美元的里程碑付款。据国内研究表明,我国65岁以上人群总体帕金森病患病率约为1700/10万,年新发病例数近10万。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


