国产新型激酶抑制剂!和黄医药在中国启动实体瘤II期临床试验,评估索凡替尼与拓益组合疗法!
来源:本站原创 2020-01-15 09:37
2020年01月15日讯 /生物谷BIOON/ --和黄中国医药科技有限公司(简称“和黄医药”或“Chi-Med”)近日宣布,在中国启动了一项索凡替尼联合拓益(特瑞普利单抗,首个国产PD-1单抗,君实生物研制)治疗晚期实体瘤患者的II期临床试验。这是继近期完成的I期剂量发现研究,以及成功制定索凡替尼与拓益II期联合给药方案后的进一步研究。这项中国II期临床试

2020年01月15日讯 /生物谷BIOON/ --和黄中国医药科技有限公司(简称“和黄医药”或“Chi-Med”)近日宣布,在中国启动了一项索凡替尼联合拓益(特瑞普利单抗,首个国产PD-1单抗,君实生物研制)治疗晚期实体瘤患者的II期临床试验。这是继近期完成的I期剂量发现研究,以及成功制定索凡替尼与拓益II期联合给药方案后的进一步研究。
这项中国II期临床试验是和黄医药与上海君实医药生物科技有限公司(“君实”)的全球合作的一部分,旨在评估和黄医药的索凡替尼(口服抗血管生成-免疫逃逸激酶抑制剂)与君实的PD-1单克隆抗体拓益联合用药疗法,测试该联合疗法同时针对肿瘤微环境中多种细胞类型和信号通路的协同抗肿瘤作用。拓益于2018年12月获中国国家药品监督管理局(“国家药监局”)批准上市。
这项II期临床试验将应用于多个实体瘤患者群体。其主要研究终点为客观缓解率(ORR)及安全性,次要研究终点包括缓解持续时间(DoR)、无进展生存期(PFS)、疾病控制率(DCR)及总生存期(OS)。该试验主要由北京肿瘤医院副院长沈琳教授牵头,详情可登陆clinicaltrials.gov,检索NCT04169672查看。
和黄医药首席执行官贺隽(Christian Hogg)表示:“我们很高兴将索凡替尼及特瑞普利单抗的组合推进至II期临床开发,并期望可以识别出能从这一创新疗法中获益的患者群体。”
2019年12月,索凡替尼用于非胰腺神经内分泌瘤的中国新药上市申请获国家药监局药品审评中心(CDE)纳入优先审评。
2019年11月,国家药监局受理了索凡替尼用于治疗非胰腺神经内分泌瘤的新药上市申请。此外,美国食品药品监督管理局(FDA)亦授予索凡替尼孤儿药资格,用于治疗胰腺神经内分泌瘤。
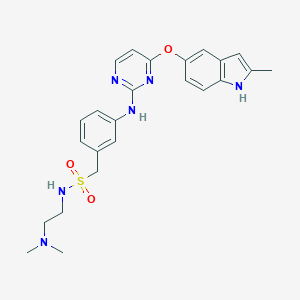
surufatinib分子结构式(图片来源:pubchem)
索凡替尼(surufatinib,亦称HMPL-012或sulfatinib)是由和黄医药自主研发的一种新型的口服酪氨酸激酶抑制剂,具有抗血管生成和免疫调节双重活性。索凡替尼可通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞生长因子受体(FGFR)以阻断肿瘤血管生成,并可抑制集落刺激因子-1受体(CSF-1R),通过调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫应答。因为具有抗肿瘤血管生成和免疫调节的双重机制,索凡替尼可能非常适合与其他免疫疗法联合使用。目前,索凡替尼正在美国开展多项概念验证研究,同时正在中国开展多项后期临床试验及概念验证研究。
据Frost & Sullivan公司估计, 中国抗血管生成血管内皮生长因子受体(VEGF/VEGFR)抑制剂的市场已从2015年的5亿美元增长至2019年的超过15亿美元,预计到2026年将达到50亿美元。
和黄医药目前拥有索凡替尼在全球范围内的所有权利。(生物谷Bioon.com)
原文出处:和黄医药
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


