2022年5月Science期刊精华
来源:生物谷原创 2022-05-31 15:16
2022年5月份即将结束,5月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年5月份即将结束,5月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.四篇Science论文构建出多组织细胞图谱,让人们对免疫和疾病有了新的认识
doi:10.1126/science.abl5197; doi:10.1126/science.abo0510; doi:10.1126/science.abl4290; doi:10.1126/science.abl4896
如今,发表在Science期刊上的四项新的研究表明,人类细胞图谱(Human Cell Atlas, HCA)绘制人体每一种细胞类型以改变我们对生物学、感染和疾病的认识的目标又迈出了里程碑式的一步。
来自国际人类细胞图谱(HCA)联盟的研究人员为人体33种器官和系统中的100多万个单个细胞绘制了高度详细的图谱,为人类健康和疾病提供了新的生物学见解,包括免疫系统。这些互补的多组织细胞图谱将有助于形成单一的人类细胞图谱,并具有许多治疗意义,包括为我们了解常见和罕见疾病、疫苗开发、抗肿瘤免疫学和再生医学提供信息。
图片来自CC0 Public Domain。
在此之前,HCA主要集中在对单个器官、组织或组织的一小部分获得深入的细胞理解。如今,来自英国韦尔科姆基金会桑格研究所、美国布罗德研究所、陈-扎克伯格生物中心的研究人员以及他们的国际合作者进行了四项主要的合作研究,开发出一些新的方法并构建出迄今为止最全面的跨组织图谱。这些图谱是公开的,使得科学家们能够精细地比较整个身体的特定细胞类型,揭示新的细胞功能,并阐明健康和疾病。
2.Science:有望取代CRISPR-Cas9的新型基因编辑工具问世!揭示IscB-ωRNA在RNA引导下切割DNA机制
doi:10.1126/science.abq7220
CRISPR开创了基因组医学的时代。从流行的CRISPR-Cas9开发出了一系列强大的工具来治疗遗传疾病。然而,有一个最后一公里的问题:需要有效地将这些工具递送到患者的每一个细胞中,而大多数Cas9太大,无法装入流行的基因组治疗载体,如腺相关病毒(AAV)。
在一项新的研究中,来自康奈尔大学的研究人员为自然界如何解决这个问题提供了一个解释:他们精确地确定了一种转座子衍生性系统如何以RNA引导的方式编辑DNA。转座子是细菌中的可移动的遗传因子。一种转座子编码IscB,IscB的大小不到Cas9的一半,但它同样能够进行DNA编辑。用IscB取代Cas9将明确地解决这种尺寸问题。相关研究结果于2022年5月26日在线发表在Science期刊上,论文标题为“Structural basis for RNA-guided DNA cleavage by IscB-ωRNA and mechanistic comparison with Cas9”。
图片来自Unsplash/CC0 Public Domain。
这些作者利用低温电镜(Cryo-EM)对来自一种转座子系统的IscB-ωRNA分子进行了高分辨率的观察。他们能够捕捉到该系统在不同构象状态下的快照。 他们甚至能够通过去除IscB的非必要部分,设计出尺寸更小的IscB变体。
3.Science:发现一种新的前列腺癌亚型,它占所有前列腺癌病例的30%左右
doi:10.1126/science.abe1505
在一项新的研究中,来自纪念斯隆-凯特琳癌症中心和威尔康乃尔医学院的研究人员发现一种先前未知的激素抵抗性前列腺癌亚型占所有前列腺癌病例的30%左右。这一结果可能为开发针对这种前列腺癌亚型患者的靶向治疗铺平道路。相关研究结果发表在2022年5月27日的Science期刊上,论文标题为“Chromatin profiles classify castration-resistant prostate cancers suggesting therapeutic targets”。

图片来自Science, 2022, doi:10.1126/science.abe1505。
在这项新的研究之前,只有两种前列腺癌亚型被描述:雄激素依赖性前列腺癌和神经内分泌前列腺癌。论文共同通讯作者、纪念斯隆-凯特琳癌症中心医生科学家Yu Chen博士将这种新表征的第三种前列腺癌亚型称为干细胞样(SCL)前列腺癌。
为了取得他们的发现,Chen博士和他的团队检查了40种不同的前列腺癌患者衍生模型,这些模型来自于在纪念斯隆-凯特琳癌症中心和威尔康乃尔医学院接受治疗的癌症患者。
4.T细胞也需要休息!Science:T细胞无法休眠,宿主更易受到感染
doi:10.1126/science.aaz8658
生物学教科书告诉我们,T细胞是免疫系统的战士,时刻准备着应对从病毒到肿瘤的各种威胁。然而,在一项新的研究中,来自耶鲁大学的研究人员指出,如果没有休息和维护,T细胞可能会死亡,并使其宿主更容易受到病原体的影响。相关研究结果发表在2022年5月27日的Science期刊上,论文标题为“The CD8α–PILRα interaction maintains CD8+ T cell quiescence”。
图片来自CC0 Public Domain。
在检测到病原体之前,T细胞一直处于静止状态。然而,保持T细胞不活动的分子机制以前是未知的。在这项新的研究中,这些作者表明,一种称为CD8a的蛋白---它存在于被称为CD8+T细胞亚群中---是保持这些T细胞处于这种休眠状态的关键。当他们剔除小鼠体内的这种蛋白时,这些保护性的CD8+T细胞无法进入休眠状态并死亡,使宿主容易受到感染。
此外,他们还发现了另外一种称为PILRa的蛋白,它为CD8a提供了一个生化信号。通过破坏这对蛋白,“记忆”CD8+T细胞(以前曾接触过病原体的CD8+T细胞)和初始CD8+T细胞(以前未接触过病原体的CD8+T细胞)都会死亡,因为它们缺乏保持静止状态的能力。
5.Science:开发出智能的瞬时起搏器,在植入后无需取出,可在体内无害地溶解
doi:10.1126/science.abm1703
去年夏天,来自美国西北大学的研究人员推出了有史以来第一种瞬时起搏器(transient pacemaker)---一种完全可植入的无线设备,在不再需要它之后会在体内无害地溶解。如今,在一项新的研究中,他们推出了一款新的智能版本,该版本集成了由四个柔软、灵活、无线、可穿戴的传感器和控制单元组成的协调网络,这些传感器和控制单元放置在上半身周围。相关研究结果发表在2022年5月27日的Science期刊上,论文标题为“A transient, closed-loop network of wireless, body-integrated devices for autonomous electrotherapy”。论文通讯作者为西北大学的John A. Rogers、Igor R. Efimov和Rishi Arora博士。
这些传感器相互沟通,持续监测身体的多种生理功能,包括体温、氧气水平、呼吸、肌肉张力、身体活动和心脏的电活动。然后,这种系统使用算法来分析这一组合活动,以便自主检测异常的心律,并决定何时和以何种速度进行心率调整。所有这些信息都传输到智能手机或平板电脑上,这样医生就可以远程监控他们的病人。
这种新的瞬时起搏器和传感器/控制网络可用于心脏手术后需要临时起搏的病人或等待永久性起搏器的病人。这种瞬时起搏器以无线方式从这种网络中的一个节点获取能量---这是一种小型无线设备,可以柔软地附着在病人的胸部。这项技术消除了对外部硬件的需求,包括电线(即导线)。
为了使这种系统能够与病人沟通,这些作者加入了一种小型的、可穿戴的触觉反馈装置(haptic-feedback device),它可以穿戴在身体的任何地方。当这些传感器检测到一个问题(如电池电量不足、设备位置不正确或起搏器故障)时,这种触觉反馈装置会以特定的模式振动,提醒佩戴者并告知他们问题所在。
6.Science:重大进展!发现一种新的微管蛋白去酪氨酸酶---MATCAP
doi:10.1126/science.abn6020
最近,蛋白vasohibin(VASH1和VASH2)与它们的辅助因子小vasohibin结合蛋白(small vasohibin-binding protein, SVBP)一起被确定为去酪氨酸酶。然而,在大多数类型的细胞中,vasohibin的失活并不能消除去酪氨酸化,这表明有一种或多种额外的去酪氨酸酶存在。而其他的微管蛋白修饰是由多个相关的酶组成的大蛋白家族进行的,没有与vasohibin非常相似的蛋白酶。在一项新的研究中,为了确定其他的去酪氨酸酶,来自荷兰癌症研究所的研究人员在单倍体人HAP1细胞中剔除了VASH1和VASH2,并使用微管蛋白酪氨酸化和去酪氨酸化进行全基因组诱变。这些基因筛选的敏感性通过紫杉醇处理或去除TTL来增强,以促进微管蛋白的去酪氨酸化或使酪氨酸裂解不可逆转。相关研究结果发表在2022年5月20日的Science期刊上,论文标题为“Posttranslational modification of microtubules by the MATCAP detyrosinase”。

微管蛋白去酪氨酸化是由不同的MATCAP和vasohibin去酪氨酸酶进行的。图片来自Science, 2022, doi:10.1126/science.abn6020。
通过这些基因筛选,这些作者确定了KIAA0895L是一种之前未被发现的去酪氨酸酶,它也是一种未经研究的没有明显蛋白酶特征的蛋白。同时移除KIAA0895L、VASH1和VASH2会导致体外培养的细胞中微管蛋白去酪氨酸化水平无法检测到。KIAA0895L的晶体结构显示了一种非典型的属于gluzincins家族的金属蛋白酶褶皱(新型冠状病毒SARS-CoV-2受体ACE2也属于gluzincins家族)。KIAA0895L由于一个简并签名基序(HExxxH而不是HExxH)中断了含有活性位点的螺旋,而没有对催化位点排列的完整性产生实质性的影响,所以没有被注释为蛋白酶。这些作者将这种蛋白重新命名为MATCAP(microtubule-associated tyrosine carboxypeptidase, 微管相关酪氨酸羧肽酶)。
MATCAP和vasohibin采用了非常不同的催化策略(前者是金属蛋白酶,后者是半胱氨酸蛋白酶)来靶向α-微管蛋白的尾部。此外,vasohibin的裂解依赖于EEY末端基序中的倒数第二个谷氨酸,并且只容忍化学上相关的苯丙氨酸替代α-微管蛋白末端的酪氨酸,而MATCAP对这种末端氨基酸残基的性质是混杂的,并且显示出对也位于更上游的α-微管蛋白尾部氨基酸残基的依赖性,以进行底物识别。无催化活性的MATCAP与完全酪氨酸化的微管结合在一起时的低温电镜结构表明,MATCAP识别同一微管原纤维(microtubule protofilament)中的微管蛋白二聚体,而VASH1-SVBP复合物位于相邻的微管原纤维之间。出乎意料的是,通过基因手段剔除小鼠中的MATCAP和SVBP导致它们的可存活下来的后代具有检测不到的去酪氨酸化水平。尽管这些小鼠后代可存活下来,但是它们在神经发生过程中显示出大脑形态上的缺陷伴随着增殖缺陷,并表现出异常的行为。
7.Science:少突胶质细胞前体细胞通过单向接触排斥引导中间神经元迁移
doi:10.1126/science.abn6204
大脑皮层是一个由细胞层切向组织成的进化上高级的大脑区域,服务于更高的认知功能。在发育过程中,大多数皮层中间神经元(以下简称为中间神经元)诞生于前脑腹侧,在那里,一些祖细胞同时产生少突胶质细胞前体细胞(oligodendrocyte precursor cell, OPC)。OPC分化为少突胶质细胞,而少突胶质细胞的主要功能是用髓鞘包裹轴突以支持动作电位的快速跳跃式传导,并为产后大脑中的神经元提供代谢支持。在前脑中已经确定了三种不同的OPC群体。这些细胞以连续的波浪形式产生,具有明确的时空模式,而且它们都从其出生地迁移到大脑中定植。最初的两波OPC细胞出生在前脑腹侧(ventral forebrain),因而被命名为vOPC。它们与中间神经元一起向大脑皮层迁移,而第三波OPC则是在出生前后由皮层壁的一些祖细胞在局部产生。尽管它们有不同的起源,但所有的OPC细胞谱系都在转录水平上趋同,这可能反映了它们对髓鞘形成的贡献。
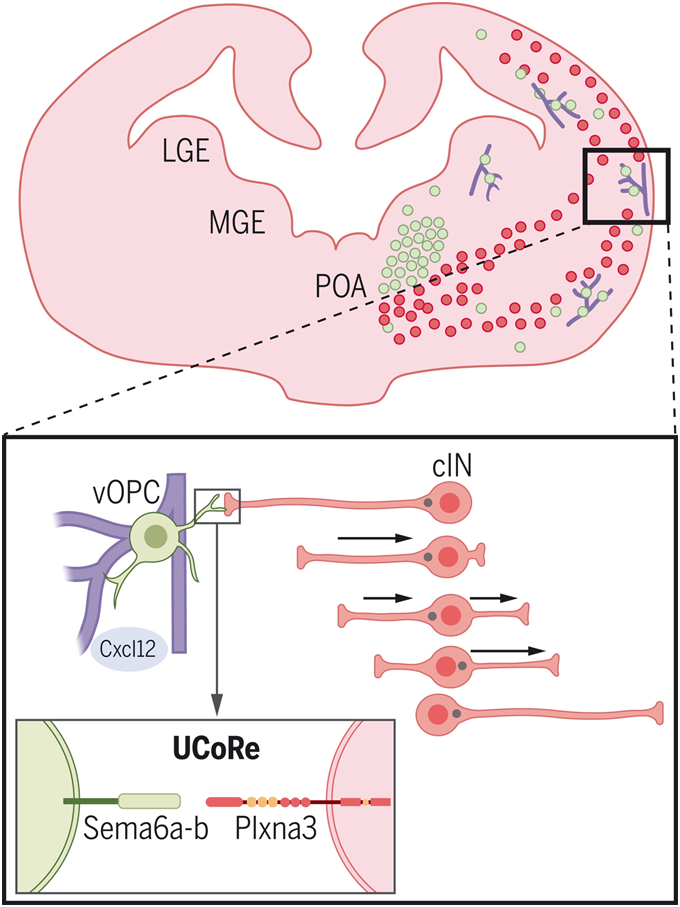
单向接触排斥为中间神经元的迁移提供指导。图片来自Science, 2022, doi:10.1126/science.abn6204。
在迁移过程中,一些神经细胞会促进暂时性的细胞相互作用,使它们在整入皮层网络后发挥更多的作用。相应地,近期的研究报告说,一些第一波vOPC在出生后早期与谱系相关的中间神经元建立突触接触。耐人寻味的是,很大一部分第一波vOPC对突触发生没有贡献,在产后第二周就被清除了。在一项新的研究中,来自比利时列日大学的研究人员通过测试vOPC是否与中间神经元交谈以支持它们同时迁移到大脑皮层,评估了vOPC在大脑发育过程中是否发挥了额外的非经典功能。相关研究结果发表在2022年5月20日的Science期刊上,论文标题为“Oligodendrocyte precursors guide interneuron migration by unidirectional contact repulsion”。
在大脑发育过程中,vOPC和中间神经元出生在前脑腹侧,并同时沿切线迁移,到达大脑皮层。在这项新的研究中,这些作者通过对小鼠遗传模型的组织学分析和活体成像显示,虽然对Cxcl12梯度有反应,但是这两个细胞群体都占据了富含这种趋化因子的相互排斥的前脑区域。活体成像分析表明,第一波vOPC而不是第二波vOPC对中间神经元进行单向接触排斥。这种机制引导中间神经元远离释放Cxcl12的血管,从而使它们能够跟随这种趋化因子的皮层梯度,后来定居在皮质层。这种接触排斥的模式是第一波vOPC-中间神经元所特有的,与自我排斥不同。它依赖于非典型的semaphorin-plexin信号的激活,在中间神经元的极性逆转时诱导它们迁移的方向变化。这种相互作用的特异性是否依赖于中间神经元的成熟程度和/或属于两种不同波的vOPC的信号传导途径仍有待确定。
8.Science:揭示衰老的神经系统在遭受损伤后再生能力下降机制
doi:10.1126/science.abd5926
轴突再生和神经功能的恢复在老年人中极为有限。因此,神经系统受伤后通常会出现严重和长期的残疾。科学家们对因衰老出现再生失败的分子机制了解不多,阻碍了在开发有效的神经系统修复疗法方面取得进展。为了促进神经系统修复策略的设计,人们迫切需要确定导致因衰老出现再生失败的关键分子机制和细胞机制。
衰老会导致细胞信号传导的广泛改变,包括代谢、免疫和整体组织平衡的变化,这在神经系统的生理学特性和损伤反应中起着关键作用。因此,在一项新的研究中,来自英国帝国理工学院的研究人员猜测衰老的神经系统在受伤后会出现独特的分子和细胞修饰,这将有助于促进因衰老而出现的再生能力下降。为此,他们通过对年轻小鼠和年老小鼠坐骨神经损伤的成熟模型中的背根神经节(dorsal root ganglia, DRG)进行RNA测序,系统性地研究了与衰老和神经系统损伤有关的分子和细胞特征。对这些机制的深入了解可能发现以前没有认识到的分子靶标,以对抗因衰老而出现的再生能力下降。相关研究结果发表在2022年5月13日的Science期刊上,论文标题为“Reversible CD8 T cell–neuron cross-talk causes aging-dependent neuronal regenerative decline”。
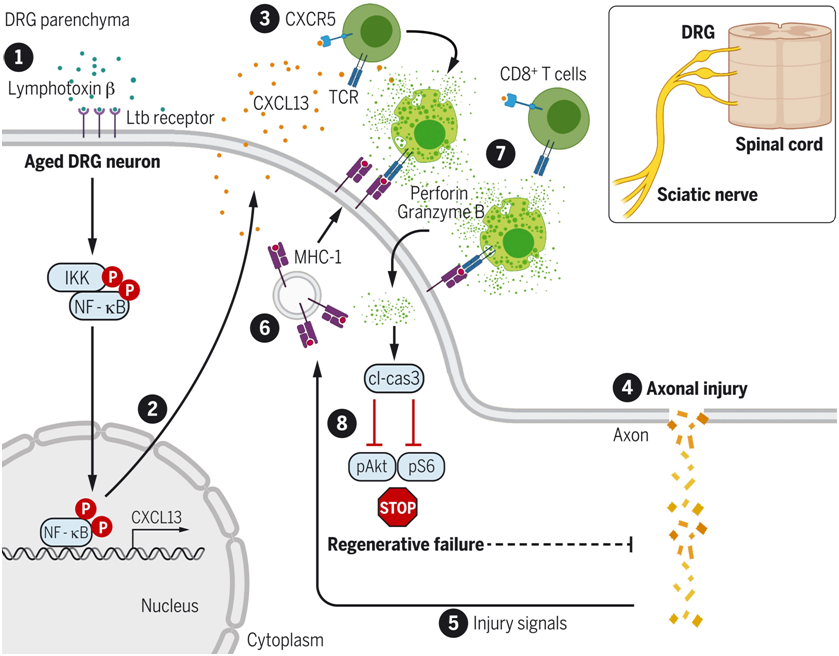
导致在感觉神经元受损后因衰老而出现再生失败的事件序列。图片来自Science, 2022, doi:10.1126/science.abd5926。
对RNA测序数据的初步分析发现,衰老主要与小鼠坐骨神经损伤后DRG中T细胞激活和信号传导的明显增加有关。随后的实验表明,衰老与坐骨神经损伤前后DRG中包括淋巴毒素在内的炎性细胞因子的增加有关。具体来说,这些作者发现淋巴毒素β是NF-κB磷酸化所必需的,NF-κB磷酸化驱动趋化因子CXCL13在DRG感觉神经元中的表达。在坐骨神经损伤后,CXCL13在通过过表达主要组织相容性复合物I型(MHC I)作为抗原呈递细胞发挥作用的神经元附近吸引了表达CXCL13受体CXCR5的CD8+ T细胞。CXCR5+CD8+T细胞与表达MHC I的感觉神经元的结合激活了caspase 3,而激活的caspase 3破坏了pAKT和pS6信号传导,从而导致再生失败。利用药物拮抗caspase 3激活可以逆转年老小鼠的再生失败,并恢复pAKT和pS6的表达。
9. Science:利用Record-seq技术记录肠道细菌的基因表达
doi:10.1126/science.abm6038
在一项新的研究中,来自瑞士苏黎世联邦理工学院、巴塞尔大学、伯尔尼大学和博特纳儿童健康研究中心的研究人员为肠道细菌配备了数据记录器功能,以此来监测肠道细菌中哪些基因是活跃的。这些肠道细菌有朝一日可能提供一种诊断疾病或评估饮食对健康影响的非侵入性手段。相关研究结果发表在2022年5月13日的Science期刊上,论文标题为“Noninvasive assessment of gut function using transcriptional recording sentinel cells”。
图片来自Pixabay/CC0 Public Domain。
这种称为Record-seq的数据记录器功能是由苏黎世联邦理工学院生物工程教授Randall Platt领导的研究人员在过去几年中基于CRISPR开发的。为了做到这一点,他们采用了CRISPR-Cas机制,这是一种天然存在于许多细菌物种中的免疫系统。如果细菌受到病毒的攻击,它们可以将病毒的DNA或RNA片段纳入自己基因组的CRISPR阵列中。这让细菌“记住”它们曾经接触过的病毒,使它们能够以更快的速度击退未来的相同病毒攻击。
为了将这一机制用作数据记录器,这些作者没有关注病毒入侵者的DNA片段,而是关注其他东西:该机制可以被利用,使细菌将它们自己的信使RNA(mRNA)片段纳入CRISPR阵列。因此,mRNA片段可以揭示哪些基因被用来表达执行细胞功能的蛋白。
为了使该方法有效,这些作者将细菌物种Fusicatenibacter saccharivorans的CRISPR阵列引入肠道细菌大肠杆菌的一个被认为对人类安全并可作为益生菌使用的菌株中。引入的内容包括一种叫做逆转录酶的蓝图,它能够将RNA逆转录成DNA。这种酶还能将mRNA中的信息转录成DNA形式,它与伴随的CRISPR相关蛋白一起是将DNA片段纳入CRISPR阵列所必需的。
10.Science:揭示大脑在快速眼动睡眠期间强化积极情绪和抑制负面情绪的机制
doi:10.1126/science.abk2734
在一项新的研究中,来自瑞士伯尔尼大学和伯尔尼大学医院的研究人员确定了大脑如何在有梦睡眠期间对情绪进行分类,以巩固积极情绪的储存,同时抑制负面情绪的巩固。这项新的研究扩大了睡眠在心理健康中的重要性,并为新的治疗策略提供了途径。相关研究结果发表在2022年5月13日的Science期刊上,论文标题为“Paradoxical somatodendritic decoupling supports cortical plasticity during REM sleep”。
处理情绪,特别是区分危险和安全,对动物的生存至关重要。在人类中,过度的负面情绪,如恐惧反应和焦虑状态,会导致创伤后应激障碍(PTSD)等病理状态。在欧洲,大约有15%的人群受到持续焦虑和严重精神疾病的影响。Adamantidis及其团队如今提供了关于大脑如何在快速眼动睡眠(REM)期间帮助强化积极情绪和削弱强烈的消极或创伤性情绪的新见解。
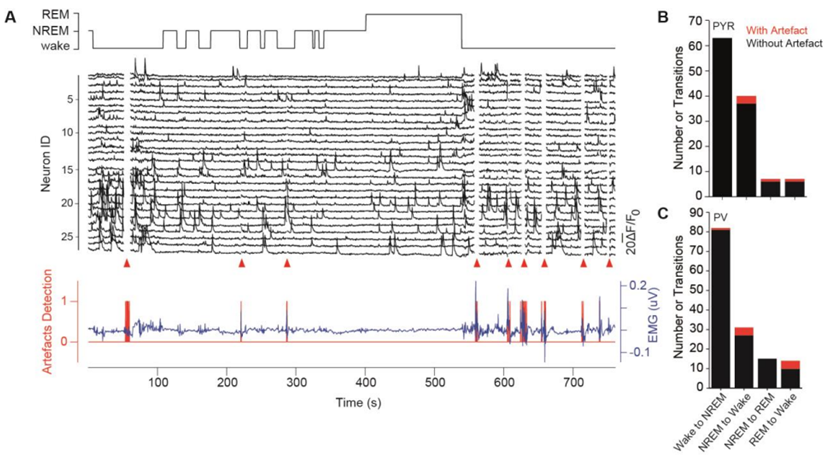
运动伪像检测和移除,图片来自Science, 2022, doi:10.1126/science.abk2734。
这些作者首先让小鼠识别与安全有关的听觉刺激和与危险有关的其他刺激(厌恶性刺激)。他们然后在睡眠-觉醒周期中记录小鼠大脑中神经元的活动。通过这种方式,他们能够绘制不同的细胞区域,并确定情绪记忆在REM睡眠期间是如何转化的。
神经元由胞体(soma)、轴突和树突组成,胞体整合来自树突的信息(输入),并通过神经元的轴突(输出)向其他神经元发送信号。这些作者获得的结果显示神经元的胞体在树突被激活时保持沉默。Adamantidis解释说,“这意味着这两个细胞区室解耦,换句话说,胞体广泛沉睡,树突广泛清醒。”这种解耦很重要,因为树突的强烈活动允许对危险和安全情绪进行编码,而胞体的抑制作用在REM睡眠期间完全阻止了神经回路的输出。换句话说,大脑倾向于在树突中辨别安全与危险,但阻止对情绪的过度反应,特别是危险。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


