Nature解读!揭示脂多糖调节子的精细化结构或有望帮助开发新型抗生素
来源:本站原创 2020-08-20 21:26
2020年8月21日 讯 /生物谷BIOON/ --当代谢途径的产物通过诱发该途径中一种关键酶类的活性的下降而减少其自身的产量时,就会发生反馈抑制,诸如此类抑制会控制脂多糖分子(LPS,lipopolysaccharide)的产生,而LPS是某些细菌外膜的一个重要组成部分,长期以来,科学家们一直推测,负责调解LPS生物合成的反馈信号通路要么是LPS本身,要么
2020年8月21日 讯 /生物谷BIOON/ --当代谢途径的产物通过诱发该途径中一种关键酶类的活性的下降而减少其自身的产量时,就会发生反馈抑制,诸如此类抑制会控制脂多糖分子(LPS,lipopolysaccharide)的产生,而LPS是某些细菌外膜的一个重要组成部分,长期以来,科学家们一直推测,负责调解LPS生物合成的反馈信号通路要么是LPS本身,要么就是其前体1,近日,一项刊登在国际杂志Nature上的研究报告中,Clairfeuille等人就通过研究报告,膜蛋白PbgA或许就是科学家们长期寻找的大肠杆菌中的LPS信号转换器,当前的研究工作通过提供与LPS结合的蛋白的高分辨率结构扩展了科学家们对PbgA的理解。
大肠杆菌有两种不同的膜结构,即内膜(磷脂双分子层)和外膜(LPS排列的外表面),LPS能在大肠杆菌的内表面开始进行组装,其组装的速度受到了LpxC酶的控制,在LPS的产生完成之前,脂质会被翻转到内膜的外表面进行进一步修饰,然后,完整的LPS会通过连接膜的蛋白桥运输到外膜的外表面。研究人员分析了这种通路是如何被调节的,即内膜上的PbgA如何通过与LapB相互作用来调节LpxC的活性,一种蛋白能够引导酶类FtsH去降解LpxC;因此,当LPS的水平较低时,PbgA就会抑制LapB和FtsH之间的相互作用,从而稳定LpxC并促进LPS的生物合成。当LPS分子的水平超过外膜的阈值时,LPS的运输就会停止,这样LPS就会在内膜的外表面发生积聚,这或许就会引发潜在的致命性不规则膜结构的形成,通过感知LPS的积累,PbgA就会释放对LapB–FtsH的抑制,这样LpxC就会被降解从而减少LPS的生物合成并恢复脂质-LPS的平衡。
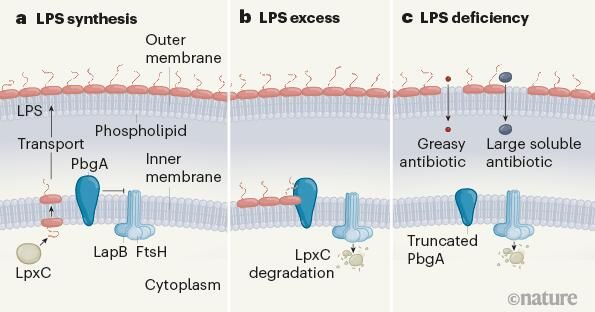
图片来源:Russell E. Bishop. Nature 584, 348-349 (2020) doi:10.1038/d41586-020-02256-x
研究者表示,携带截断形式PbgA的大肠杆菌仍然能够存活,但却会长期缺乏LPS,在这些突变体中,磷脂会迁移到外膜的外表面从而产生混合膜结构,这种混合膜结构中包含散布在LPS-磷脂膜区间的磷脂双层斑块,而磷脂双层斑块能允许抗生素和洗涤剂进入细胞。此前研究结果表明,当磷脂分子存在于外表面时,一种被称为棕榈酸酯的油脂官能团就会被纳入到LPS中,如今研究者在PbgA突变体的外膜LPS中发现了棕榈酸酯。此外,研究人员还使用X射线晶体衍射学技术以1.9A的分辨率解析了PbgA的结构,他们发现,PbgA属于一个包含EptA蛋白的酶类家族,EptA蛋白能对LPS的脂质A结构域添加磷脂衍生的分子修饰,脂质A由两个磷酸化的糖分子组成,通过修饰这些磷酸基团,EptA就能为细胞提供与脂质A结合的抗生素的耐受性。
研究者表示,PbgA的外表面能与LPS分子紧密结合,随后他们重新评估了PbgA的低分辨率结构,结果证实了PbgA能与LPS的脂质A结构域结合,尽管磷脂部分占据了结合LPS附近的一个位点,但PbgA已经失去了EptA用来催化LPS修饰的氨基酸侧链,而PbgA是否能够保留酶的活性还有待于进一步确定。PbgA是一种能被改造成为受体的蛋白质,其能在内膜的外表面感知LPS,该结构或许就支持了一种模型,即PbgA–LapB–FtsH–LpxC的调节回路或许能作为一种控制机制,调节LPS的生物合成来满足细胞之间相互连接的双膜的物理需求,实际上,研究人员也证实了PbgA和LapB在膜中发生直接物理相互作用的发现。但是,LPS-PbgA结合如何释放PbgA对LapB-FtsH相互作用的抑制作用或许仍然是个未知数。
研究者Clairfeuille及其同事通过研究发现,PbgA能通过一个连接域与脂质A基团进行结合,其所使用的的氨基酸序列在任何其它LPS结合蛋白中并未进行报道,这种LPS结合基团的突变或许就会抑制PbgA的功能,在最后一组实验中,研究者证实了基于这种序列的合成肽类能够结合LPS并抑制细菌的生长,而通过合理的设计,研究人员就能改善肽类的抗生素抗生素谱和效力。
多粘菌素能通过两个磷酸化的糖分子(但PbgA只有一个结合位点)结合脂质A,多粘菌素抗生素粘菌素在临床上常常被用作治疗感染的最后手段,同时其还能增加外膜的通透性,从而使得细菌对更有效的抗生素变得敏感,研究者指出,PbgA衍生的肽类也能使细菌对其它抗生素变得敏感,其能与粘菌素协同作用,且不受EptA催化的LPS修饰的阻碍。PbgA是大肠杆菌中为数不多的没有明确功能的必须蛋白质之一,PbgA也是LPS的信号转到器,其能为开发新型抗生素提供一定的思路和希望。(生物谷Bioon.com)
参考资料:
【1】Clairfeuille, T., Buchholz, K.R., Li, Q. et al. Structure of the essential inner membrane lipopolysaccharide–PbgA complex. Nature 584, 479–483 (2020). doi:10.1038/s41586-020-2597-x
【2】Russell E. Bishop. Structure of a lipopolysaccharide regulator reveals a road to new antibiotics, Nature 584, 348-349 (2020) doi: 10.1038/d41586-020-02256-x
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


