两篇Nature论文揭示FAM72A基因在B细胞抗体多样化和成熟中起着关键作用
来源:本站原创 2021-11-25 18:17
在一项新的研究中,来自加拿大多伦多大学的研究人员发现一个被忽视的基因在抗体产生中起着重要作用。相关研究结果于2021年11月24日在线发表在Nature期刊上。
2021年11月24日讯/生物谷BIOON/---高效的体液反应依赖于DNA损伤、诱变(mutagenesis)和易错的DNA修复。基于体细胞高频突变(somatic hypermutation)和类别转换重组(class switch recombination)的B细胞受体多样化是由激活诱导胞啶脱氨酶(activation-induced deaminase, AID)介导的DNA中的胞嘧啶脱氨,以及随后由尿嘧啶DNA糖苷酶(UNG)对由胞嘧啶脱氨产生的尿嘧啶进行切除和错配修复蛋白进行修复引发的。尽管DNA中出现的尿嘧啶被准确地修复,但在体细胞高频突变和类别转换重组的背景下,这些途径是如何被用于产生突变和双链DNA断裂的,目前尚不清楚。
抗体有助于免疫系统识别和对抗包括SARS-CoV-2在内的病毒、细菌和其他传染性病原体。在一项新的研究中,来自加拿大多伦多大学的研究人员发现一个被忽视的基因在抗体产生中起着重要作用。相关研究结果于2021年11月24日在线发表在Nature期刊上,论文标题为“FAM72A antagonizes UNG2 to promote mutagenic repair during antibody maturation”。 这些作者发现这个称为FAM72A的基因通过使AID发挥作用,促进了高质量抗体的产生。二十年来,免疫学家们已经知道AID对于产生能够清除感染的抗体是必不可少的,但其作用的全部机制仍然是未知的。论文通讯作者、多伦多大学特默蒂医学院免疫学教授Alberto Martin说,“我们的研究结果解答了一个长期存在的问题:AID如何发挥作用。FAM72A帮助AID促进抗体基因的突变,而这些突变对于有效抗体的产生是至关重要的。”
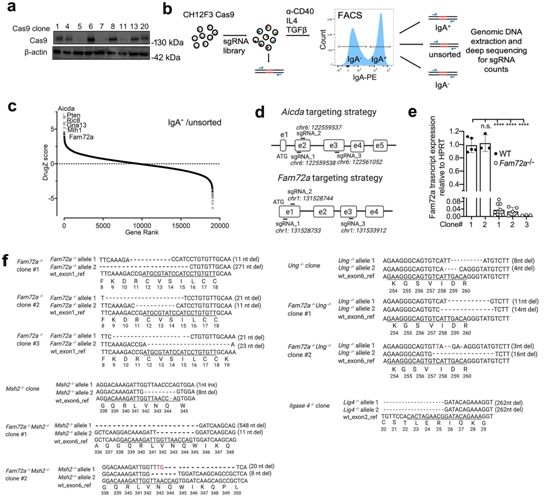
在CH12细胞中验证FAM72A在类别转换重组期间的作用。图片来自Nature, 2021, doi:10.1038/s41586-021-04144-4。
导致DNA持久变化的基因突变是通过这种诱变过程发生的。在抗体产生的背景下,诱变主要通过AID驱动的体细胞高频突变和类别转换重组机制展开---这两种机制帮助抗体获得它们对抗各种病原体所需的多样性和效价。
Martin实验室的研究结果应有助于科学家们更好更广泛地了解抗体产生,而且它们也对癌症有影响。产生抗体的B细胞不受控制的突变与B细胞淋巴瘤有关,而FAM72A在其他癌症中的存在水平非常高,如胃肠癌、乳腺癌、肺癌、肝癌和卵巢癌。Martin说,“我们的数据显示,高水平的FAM72A会促进抗体基因的突变,因此FAM72A的水平增加可能会通过增加突变来刺激癌症的产生、进展或抗药性。”Martin团队如今正在探索这些可能性。
耐人寻味的是,与其他哺乳动物不同,人类有FAM72A的四个基因版本,它们在癌症和抗体产生中的作用仍然未知。
Martin实验室的博士后研究员Yuqing Feng首先通过全基因组CRISPR筛选将FAM72A确定为一个感兴趣的基因。她利用多伦多大学分子遗传学系的Jason Moffat教授设计的技术进行了这种基因筛选实验。Feng说,“这个平台是发现新基因的一个非常强大的工具,Moffat团队在设计和执行这种基因筛选方面提供了宝贵的建议。”
Martin团队发现,FAM72A是B细胞对AID诱导的脱氧尿嘧啶进行易错加工的一个主要决定因素。Fam72a缺陷的CH12F3-2 B细胞和来自Fam72a-/-小鼠的原代B细胞表现出类别转换重组的减少、免疫球蛋白和Bcl6基因的体细胞高频突变的减少,以及全基因组脱氧脲嘧啶的减少。来自Fam72a-/-小鼠的B细胞中的体细胞高频突变谱与在缺乏尿嘧啶DNA糖基化酶2(UNG2)的小鼠中观察到的相反,这表明UNG2在FAM72A缺陷的细胞中活性过高。事实上,FAM72A与UNG2结合,导致细胞周期G1期的UNG2蛋白水平降低,这与较高的AID活性相吻合。因此,FAM72A导致U-G错配持续到S期,导致对AID诱导的脱氧尿嘧啶的错配修复容易出错。通过使通常有效地从DNA中去除脱氧尿嘧啶的DNA修复途径失效,FAM72A使AID能够对抗体成熟发挥其全部作用。
该平台产生了一个较短的基因名单,这些基因大多具有已知功能,可能在B细胞诱变中发挥作用,但Feng说,她对这个名单上很少被表征的基因更感兴趣。FAM72A从这一名单中脱颖而出,部分原因是人们对其生物学特性知之甚少。
Feng说,“我曾读过一篇2008年的论文,它提出FAM72A与UNG2结合,但没有明显的功能后果。这很有趣,因为我们知道UNG2在我们研究的途径中很重要。”
这种结合被证明是一个重要的线索。Feng能够在B细胞的实验中发现,FAM72A与UNG2结合并导致UNG2受到破坏,从而使诱变发生。
Martin实验室的另一位博士后研究员Conglei Li在小鼠身上重现了这些结果。Li说,“我们产生了缺乏FAM72A的基因敲除小鼠,并观察到它们的抗体反应受损。”Li还发现,当UNG2过度活跃时,它可以破坏AID的有益作用。
Li说,他很感激Martin实验室能够在COVID-19大流行期间继续合作---当时多伦多大学的大多数研究不得不停止。Feng同意这种看法。Feng说,“我们的团队克服了许多困难,在COVID-19大流行期间继续这项研究,从减少动物种群到自我隔离,再到在实验室的有限时间和轮班工作。我们真地对我们的研究工作充满激情,通过共同努力,我们没有让COVID阻止我们。”
在同一天发表在Nature期刊上的另一篇标题为“Fam72a enforces error-prone DNA repair during antibody diversification”的论文中,法国国家科学研究中心的Bernardo Reina-San-Martin博士及其团队对参与类别转换重组的基因进行了全基因组CRISPR-Cas9敲除筛选,并鉴定出一个称为FAM72A的基因,它所编码的蛋白与UNG(UNG2)的核异构体相互作用并在几种癌症中过度表达。
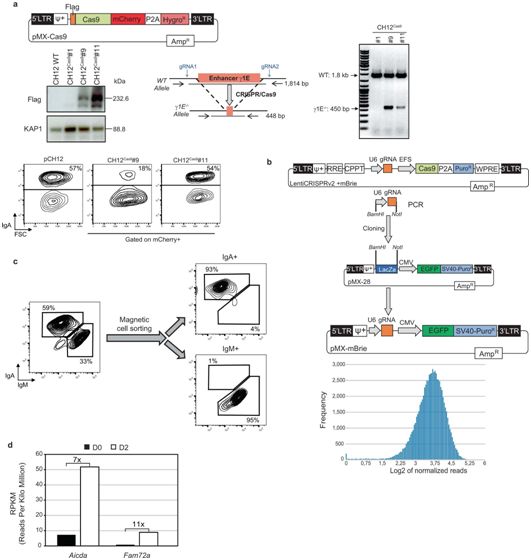
建立CRISPR/Cas9全基因组敲除筛选,图片来自Nature, 2021, doi:10.1038/s41586-021-04093-y。
他们发现,FAM72A-UNG2的相互作用控制着UNG2的水平,而且在在Fam72a/-B细胞中,由于UNG2的上调,类别转换重组出现缺陷。此外,他们发现体细胞高频突变在Fam72a-/-B细胞中减少,并且在UNG2上调后其模式发生倾斜。
这些研究结果支持一种模型,即FAM72A与UNG2相互作用,通过触发UNG2的降解来控制它的生理水平,调节尿嘧啶切除的水平,从而调节易错DNA修复和无错DNA修复之间的平衡。这些发现对肿瘤发生有潜在的影响,因为Fam72a的过量表达所介导的UNG2水平的降低会使平衡转向诱变性DNA修复,使细胞更容易获得突变。(生物谷 Bioon.com)
参考资料:
Yuqing Feng et al. FAM72A antagonizes UNG2 to promote mutagenic repair during antibody maturation. Nature, 2021, doi:10.1038/s41586-021-04144-4.
Mélanie Rogier et al. Fam72a enforces error-prone DNA repair during antibody diversification. Nature, 2021, doi:10.1038/s41586-021-04093-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



