CAR-T细胞疗法研究进展(第22期)
来源:本站原创 2021-05-31 23:58
2021年5月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一
2021年5月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nat Commun:利用CRISPR/Cas9介导的A2AR基因缺失可显著增强CAR-T细胞抵抗一系列癌症的疗效
doi:10.1038/s41467-021-23331-5
在CAR-T细胞疗法中,先收集患者自身的免疫细胞,并对它们进行基因改造,然后将它们输注回患者体内以对抗他们体内的癌症。世界各地的科学家们正在开发一种潜在的新方法,使得CAR-T细胞疗法对乳腺癌和其他实体癌更加有效。
腺苷(adenosine)是一种限制抗肿瘤免疫反应的免疫抑制因子,通过激活腺苷A2A受体(adenosine A2A receptor, A2AR)来抑制包括T细胞在内的多种免疫细胞亚群。在一项新的研究中,澳大利亚研究人员通过使用小鼠和人类CAR-T细胞,发现利用临床相关的CRISPR/Cas9策略靶向A2AR,可显著提高这些细胞的体内疗效,从而改善小鼠的生存。相关研究结果于2021年5月28日发表在Nature Communications期刊上,论文标题为“CRISPR/Cas9 mediated deletion of the adenosine A2A receptor enhances CAR T cell efficacy”。
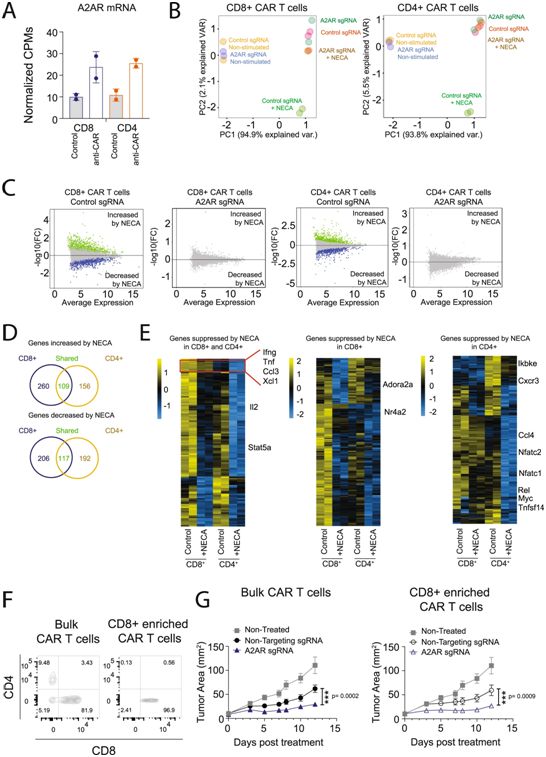
CRISPR/Cas9靶向A2AR可增强CD8+和CD4+CAR-T细胞的作用。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-23331-5。
这些结果表明,与shRNA介导的A2AR敲降或与A2AR药物拮抗剂相结合相比,使用CRISPR/Cas9诱导A2AR的完全敲除是一种增强CAR-T细胞功能的卓越治疗方法。鉴于经过CRISPR/Cas9基因编辑的CAR-T细胞正在用于临床试验,这种方法很容易转化为临床应用。此外,通过CRISPR/Cas9介导的基因编辑靶向A2AR适用于CAR-T细胞治疗包括乳腺癌、卵巢癌、肺癌、急性髓系白血病、多发性骨髓瘤和非霍奇金淋巴瘤在内的多种肿瘤类型,在这些肿瘤类型中,人们已发现腺苷信号可抑制抗肿瘤免疫反应。
2.Nature子刊:对人iPS细胞进行基因编辑,开发出一种通用的癌症免疫疗法---CAR iPS-T细胞疗法
doi:10.1038/s41551-021-00730-z
癌症免疫疗法利用患者自身的免疫系统来抗击癌症。它们因对某些癌症的惊人效果而广为人所知。作为癌症免疫疗法中的一种类型,细胞疗法利用从患者肿瘤中获取的免疫细胞,对它们进行加工以增强它们的抗癌能力,然后将它们灌注回患者体内。然而,目前的临床疗法主要使用患者自身的细胞,从而限制了获得这类疗法的患者数量。科学家们正在开发诱导性多能干细胞(ips细胞)技术,使所有患者都能获得癌症免疫疗法。
在一项新的研究中,来自日本京都大学的研究人员报告了对ips细胞进行基因编辑如何导致一种不依赖患者细胞的通用癌症免疫疗法。相关研究结果发表在2021年5月的Nature Biomedical Engineering期刊上,论文标题为“Generation of hypoimmunogenic T cells from genetically engineered allogeneic human induced pluripotent stem cells”。
因此,这些作者探索了哪些基因可以编辑,为CD8 T细胞选择了B2M基因,为CD4 T细胞选择了CITTA基因,为NK细胞选择了一种特定类型的HLA(HLA-E)。所有这些基因以前都被认为调节各自免疫细胞的激活。此外,他们敲除了PVR基因,这进一步降低了NK细胞的活性。他们随后将基因编辑过的iPS细胞分化为T细胞(iPS-T细胞),发现ips-T细胞具有良好的抗癌效果,而不刺激免疫细胞。
嵌合抗原受体(CAR)T细胞(CAR-T)疗法是最有效的癌症免疫疗法。CAR是一种合成受体,大大增强了T细胞寻找和杀死癌细胞的能力。目前临床上的CAR-T细胞疗法使用的是患者自己的T细胞,具有上述提及的缺点。这些作者在将CAR技术整合到他们的ips-T细胞中,并证实基因编辑并没有损害CAR的有效性。
随后,他们将CAR添加到ips-T细胞中,并将这些细胞注射到患有白血病的小鼠体内。相比于没有经过基因编辑的CAR iPS-T细胞,经过基因编辑后躲避免疫系统的的CAR ips-T细胞显示出更强的抗癌效果。他们的实验显示人源化小鼠的CD4和CD8 T细胞受到野生型CAR iPS-T细胞的刺激,但是如果先给野生型CAR ips-T细胞进行基因编辑,它们就不会刺激人源化小鼠的CD4和CD8 T细胞。
3.Nat Immunol:白介素-10所介导的终末耗竭CD8+ T细胞的代谢重编程或能增强机体的抗肿瘤免疫反应
doi:10.1038/s41590-021-00940-2
T细胞耗竭是癌症免疫疗法面临的主要障碍之一,在耗竭的CD8+肿瘤浸润淋巴细胞中,终末耗竭的细胞亚群会因自身的细胞毒性效应功能而直接有助于肿瘤细胞的杀灭作用;然而,这类细胞亚群对免疫检查点阻滞并没有反应,因此很难通过恢复增殖能力来使其重获活力。近日,一篇发表在国际杂志Nature Immunology上题为“Metabolic reprogramming of terminally exhausted CD8+ T cells by IL-10 enhances anti-tumor immunity”的研究报告中,来自瑞士洛桑联邦理工学院等机构的科学家们通过研究揭示了如何恢复一种强大但功能上具有惰性的抗癌免疫细胞亚群,这类细胞通常在肿瘤内被发现,且能用于癌症治疗。
文章中,研究人员揭示了一种名为白介素-10的免疫因子是如何调节终末耗竭的肿瘤浸润T淋巴细胞(TILs)的功能恢复的,迄今为止这些T细胞细胞已经被证明无法受到免疫疗法的刺激;研究结果表明,当该因子与细胞疗法相结合后就能清除黑色素瘤和结肠癌小鼠模型机体中的肿瘤。研究者Ho说道,本文中我们首次发现,终末耗竭的TILs能被直接恢复活力以便潜在的抗癌活性能被恢复;而且这种活力的恢复是通过白介素-10所诱导的细胞代谢重编程来实现的。
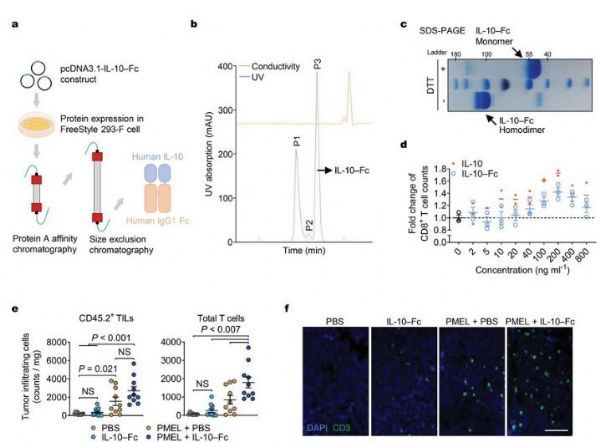
IL-10–Fc能促进肿瘤浸润对T细胞的浸润,但对其它免疫细胞的效应较为轻微。图片来源:Guo, Y., et al. Nat Immunol 22, 746–756 (2021). doi:10.1038/s41590-021-00940-2。
为了一探究竟,研究人员在过继细胞疗法(ACT)中加入了一种工程化、长效版本的白介素-10(IL-10/Fc),即通过输注肿瘤靶向作用T细胞来治疗癌症;同时还检测了这种组合在治疗黑色素瘤小鼠模型中的治疗效果;结果发现,这种新型疗法能提高终末耗竭TILs的数量和功能,并能让接受治疗的小鼠中90%的小鼠机体中的肿瘤消退且治愈(仅使用ACT没有效果,而且仅使用IL-10/Fc疗法会使得肿瘤消退程度有限)。值得注意的是,80%存活的小鼠会产生对癌症的免疫记忆,当治疗后两个月就能够自发排斥植入其机体中的相同肿瘤了。
这或许就表明,如果白介素-10被加入到了ACT中,其或许就能赋予机体抵御癌症生长的长期保护力。此外研究人员还检测了IL-10/Fc对CAR-T细胞的影响,CAR-T细胞能靶向作用携带特殊分子标志物的癌细胞,经过IL-10/Fc处理的CAR-T细胞能够诱导被植入了结肠癌肿瘤大约90%的小鼠实现癌症的完全治愈。研究者发现,IL-10/Fc能特异性地对终末耗竭TILs发挥作用,而并非是祖辈耗竭TILs;结果就表明,其能重编程终末耗竭TILs的代谢,即从其从营养物质中获取能量的过程开始。这反过来又会导致其基因表达程序发生全面改变,从而驱动其功能重新激活和增殖发生,IL-10/Fc对人类机体的TILs和CAR-T细胞有着相同的效应。
4.Science子刊:更高效的CAR-T细胞疗法有望治疗胰腺癌等实体瘤
doi:10.1126/scitranslmed.abc3196
作为一种实体瘤,胰腺导管腺癌(PDAC)是一种高度侵袭性肿瘤,尽管进行了积极的外科手术、放疗和高剂量化疗,但是它的5年生存率小于9%。尽管CAR-T细胞疗法已经成为CD19阳性B细胞恶性肿瘤的一种令人兴奋的有效治疗选择,但是它在实体瘤领域的表现尚未达到类似的疗效。嵌合抗原受体(CAR)T细胞(CAR-T)无法有效和持久地控制实体瘤的原因有很多,包括实体瘤特异性细胞表面靶标的缺乏和肿瘤抗原的异质性;实体瘤微环境对T细胞激活、衰竭和持久性的免疫抑制影响;以及体外扩增的CAR-T细胞自然转移到肿瘤部位的低效率。为了应对这些挑战,许多科学家们正在使用一些优雅的策略,试图通过CAR介导的外源分子表达或基因组编辑方法来改变T细胞生物学。
在一项新的研究中,来自美国贝勒医学院的研究人员测试了一种假设,即作为一种在多种炎症背景下多次鉴定和表征的记忆T细胞亚群,TCRαβ CD8+CD161+ T细胞可能作为CAR T细胞疗法的一种改进平台,这是因为科学家们认为在实体瘤环境中CAR成功的关键特征,如持久性、组织外渗和连续杀伤,似乎是这个T细胞亚群所固有的。相关研究结果发表在2021年5月5日的Science Translational Medicine期刊上,论文标题为“A subset of cytotoxic effector memory T cells enhances CAR T cell efficacy in a model of pancreatic ductal adenocarcinoma”。
在这项新的研究中,这些作者发现,在存在IL-7、IL-15和IL-21的混合物的情形下,大量外周血单核细胞(PBMC)衍生的CAR-T细胞、CD8+CD161- CAR-T细胞和CD8+CD161+ CAR-T细胞的体外培养和扩增,只使CD8+CD161+ CAR-T细胞群体受益,而且大量PBMC T细胞或CD8+CD161-T细胞的表型不会发生在不含IL-21或仅含IL-2的培养条件下发生的改变。在这些条件下,用CAR转导的CD8+CD161+T细胞在裂解能力和持久性方面优于大量的PBMC T细胞和作为对照的CD8+CD161-T细胞。此外,在PDAC疾病原位模型和播散模型中,与用CAR转导的大量PBMC T细胞相比,用CAR转导的CD8+CD161+T细胞介导的的体内存活率显著提高。
一些科学家们已报告说,最佳的CAR-T细胞活性是通过平衡的用CAR转导的CD4+和CD8+ T细胞群体实现的。基于此,这些作者很想推测,通过同时使用用CAR转导的CD4+CD161+ T细胞,可能会进一步改善CD8+CD161+CAR-T细胞疗法。然而,目前还不清楚这样的策略是否有益。他们的结果一致表明,与由CD4+CAR-T细胞和CD8+ CAR-T细胞组成的大量PBMC相比,CD8+CD161+CAR-T细胞显示出更强的细胞毒性和持久的抗肿瘤反应。此外,由于大多数表达CD161的CD4+细胞是分泌IL-17的称为Th17细胞的调节性T细胞,具有较低的细胞毒性分子的表达,目前还不清楚CD161+CD8+CAR-T细胞和CD161+CD4+CAR-T细胞的组合是否会表现出优于单独的CD8+CD161+CAR-T细胞的功能活性。尽管如此,未来的实验将探索这种令人好奇的可能性。
5.两篇Science子刊:治疗实体瘤的智能细胞疗法出炉
doi:10.1126/scitranslmed.abe7378; doi:10.1126/scitranslmed.abd8836
抗击癌症的免疫疗法对许多患者来说是一种拯救生命的进步,但是这种方法只对少数类型的恶性肿瘤有效,对大多数患有实体瘤的癌症患者来说,几乎没有治疗选择。如今,在两项新的研究中,来自美国加州大学旧金山分校的研究人员展示了如何设计能够有效地对抗实体瘤的智能免疫细胞,从而为治疗长期以来无法用免疫疗法治疗的一系列癌症打开了大门。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题分别为“SynNotch-CAR T cells overcome challenges of specificity, heterogeneity, and persistence in treating glioblastoma”和“SynNotch CAR circuits enhance solid tumor recognition and promote persistent antitumor activity in mouse models”。
通过将基本的计算能力“编程”到旨在攻击癌症的免疫细胞(T细胞)中,这些作者已经克服了一些主要障碍,这些障碍至今仍使这些策略无法进入临床。这两篇新论文显示,由此产生的“智能”疗法比以前的方法更精确、更灵活、更彻底,而且这种方法可能在不久的将来就可以进行临床试验。
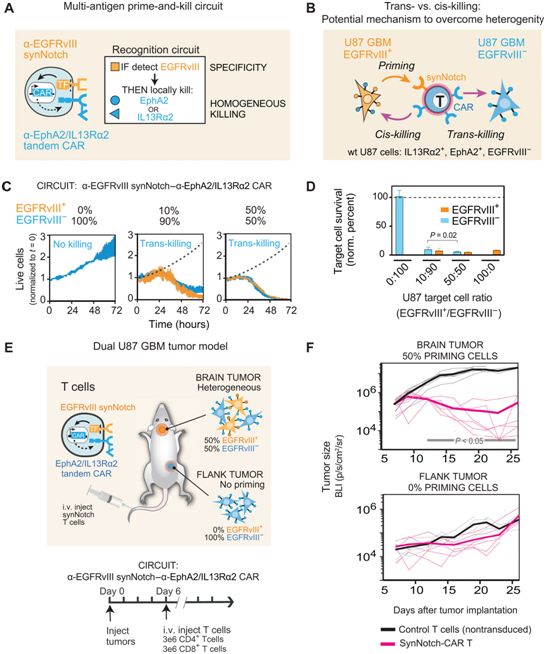
T细胞中的多抗原prime-and-kill回路提供了一种克服抗原异质性同时仍然保持较高的肿瘤特异性的总体策略。图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abe7378。
在第二篇论文中,这些作者发现这种系统的组分可以像可更换的螺丝刀的头一样被换掉,以靶向身体其他部位中难以治疗的癌症。他们还确定了一套特别重要的“螺丝刀头(screwdriver heads)”,它们可以成为对付卵巢癌、肺癌和其他器官癌症的有力工具。
此外,这两篇论文都解决了所谓的“T细胞衰竭(T-cell exhaustion)”问题,这是一个长期存在的挑战,即传统的CAR-T细胞---在一些最有前途的癌症免疫疗法背后,通过重新编程来寻找入侵者的T细胞---在与癌症进行长期的斗争时疲惫了。由此产生的新型智能细胞在整个战斗过程中始终保持强大,在不直接与癌症打交道时,通过切换到待机模式来保存能量。这些发现解决了所有一直阻碍着为患有这些癌症的患者开发免疫疗法的关键挑战。这种新策略已经准备好向临床试验迈进。
6.Science子刊:我国科学家开发出比CAR-T细胞疗法更有效摧毁实体瘤的STAR-T细胞疗法
doi:10.1126/scitranslmed.abb5191
在一项新的研究中,来自中国清华大学、清华大学-北京大学生命科学联合中心、首都医科大学和华夏英泰(北京)生物技术有限公司的研究人员合作开发了一种用于抗癌治疗的合成T细胞受体,以不同的方式增加T细胞的效力,有望对抗实体瘤。通过解决CAR-T疗法中的两个明显的弱点,该合成T细胞受体不仅具有寻找和摧毁实体瘤同时让健康组织不受影响的能力,而且还赋予这种抗癌武器强大的持久性来完成这项工作。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors”。
这项新研究尽管仅在动物模型中开展,但是它是向针对实体瘤的新型CAR-T细胞疗法迈出的诱人一步,而这正是近年来全球竞赛的热门课题之一。这种新方法称为STAR-T细胞疗法,它与CAR-T细胞疗法的不同之处在于它的开发方式(使用合成受体)以及它如何利用强大的细胞信号转导活性来瞄准癌抗原。与CAR-T细胞一样,STAR-T细胞经激活后追捕肿瘤细胞并杀死癌症。
这些作者写道,CAR-T细胞疗法已在治疗B细胞恶性肿瘤方面显示出较高的反应率和持久的疾病控制;然而,在实体瘤方面,CAR-T细胞显示出有限的疗效,这部分上归因于CAR信号转导的内在缺陷。
这些作者没有修改CAR-T细胞疗法来产生STAR-T细胞疗法。相反,他们设计了一种合成T细胞受体(Synthetic T cell receptor)和一种抗原受体(Antigen Receptor),经过基因改造后表达这两种受体的T细胞(即STAR-T细胞)结合了CAR-T细胞的特征,但增加了内部的信号转导机制来模拟天然的T细胞。
在多种小鼠模型中,相比于CAR-T细胞,STAR-T细胞能够更好地控制多种实体瘤类型。在这些实验中,STAR-T细胞并没有像CAR-T细胞用于对付实体瘤时那样,变得功能衰竭。这些作者指出,CAR-T细胞的功能衰竭和无效是由于一种称为抗原非依赖性信号转导(tonic signaling)的现象,这是一种不协调的T细胞信号持续激活。当CAR-T细胞用于治疗实体瘤时还存在其他问题:它们会被肿瘤内部和周围的分子所抑制。
在这项新的研究中,STAR-T细胞通过迅速诱导患有胶质母细胞瘤以及肝癌和肺癌的试验小鼠体内的肿瘤消退,显示了对抗实体瘤细胞的强大活性。这些小鼠都没有显示出副作用的证据。STAR介导强而灵敏的T细胞受体样信号转导,STAR-T细胞表现出比传统CAR-T细胞更少的功能失调和更好的增殖。此外,STAR-T细胞比CAR-T细胞显示出更高的抗原敏感性,这在临床使用中具有减少抗原丢失和诱发肿瘤复发风险的潜力。
7.Nat Med:缩短抗原结合结构域的接头可提高CD22 CAR-T细胞的疗效
doi:10.1038/s41591-021-01326-5
尽管靶向CD19的嵌合抗原受体(CAR)T细胞(CAR-T)能够在B细胞急性淋巴细胞白血病(B-ALL)患者中诱导病情缓解,但是较大的一部分患者会因CD19丢失发生疾病复发。与CD19一样,CD22在B系细胞中广泛表达,因此可作为B-ALL免疫治疗的替代靶点。
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现很多B-ALL患者在接受靶向CD22的CAR-T细胞治疗后没有反应,于是试图探究其中的原因。他们发现,当涉及到将CAR的抗原结合结构域中可变重链区和可变轻链区连接在一起的接头(linker)的长度时,少即是多(less is more),其中抗原结合结构域使得CAR-T细胞能够结合肿瘤细胞并攻击它们。相关研究结果于2021年4月22日在线发表在Nature Medicine期刊上,论文标题为“Antigen-independent activation enhances the efficacy of 4-1BB-costimulated CD22 CAR T cells”。
这些作者指出,几个氨基酸的微小差异就能给患者带来巨大的变化;在他们从接头上移除15个氨基酸后,将CAR的抗原结合结构域中的可变重链区和可变轻链区连接在一起,并预先激活CAR-T细胞。
综上所述,这些作者发现,缩短连接CAR抗原结合结构域中可变重链和可变轻链的氨基酸接头,推动了受体同源二聚体化和抗原非依赖性信号转导。与基于CD28的CAR相比,基于4-1BB的自主信号转导的CAR表现出增强的免疫突触形成、促炎症基因激活和卓越的效应功能。他们在几种CAR构建体中证实了自主信号转导和增强功能之间的这种联系,并在这些观察的基础上,设计了一种新的短接头CD22单链可变区片段用于临床评估。他们的研究结果表明,基于4-1BB的抗原非依赖性信号转导(tonic signaling)有利于CAR的功能,并展示在CAR-T细胞疗法的设计和实施中,从病床边到实验室再到病床边的转化是有实用性的。
8.Nat Commun:鉴定出CAR-T细胞治疗胰腺癌的潜在靶标
doi:10.1038/s41467-021-21774-4
胰腺癌是一种毁灭性的疾病。在过去的几十年里,这种癌症的5年总生存率仍然不足5%,未发生较大变化,目前它是西方国家癌症相关死亡的第四大原因。手术仍然是唯一有可能治愈这种癌症的方法,但只有约20%的患者在诊断时处于手术可切除的疾病阶段。在最先进的治疗方法下,手术可切除的患者的中位总生存期为26个月,然而已发生转移的患者的中位总生存期为不到6个月。因此,对新治疗方案的需求尚未得到满足。嵌合抗原受体(CAR)T细胞(CAR-T)是一种新的有前途的治疗方法。对胰腺导管腺癌(PDAC)进行有效细胞免疫治疗的一个主要障碍是缺乏合适的肿瘤特异性抗原。
在一项新的研究中,德国研究人员进行了经验性筛选旨在发现治疗PDAC的CAR候选靶标,确定了四个候选靶标:CLA、TSPAN8、CD66c和CD318。他们发现CLA在上皮性肿瘤上表达。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Identification of CD318, TSPAN8 and CD66c as target candidates for CAR T cell based immunotherapy of pancreatic adenocarcinoma”。
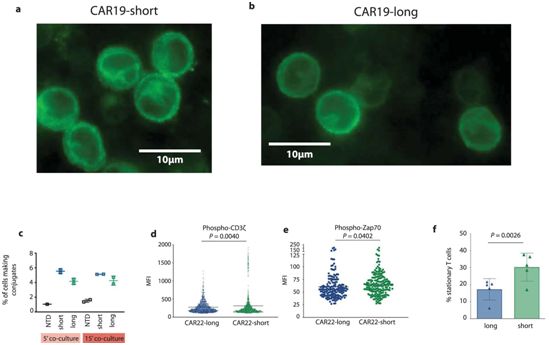
图片来自Nature Medicine, 2021, doi:10.1038/s41591-021-01326-5。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


