Cell:新方法筛选大规模遗传数据,有望鉴定出致先天性心脏病的蛋白网络
来源:本站原创 2022-02-21 19:07
在一项新的研究中,来自美国格拉德斯通研究所的研究人员开发出一种新方法,用于识别可能在先天性心脏病中发挥重要作用的基因变体,为加快研究这一严重疾病提供了机会。
2022年2月21日讯/生物谷BIOON/---近1%的儿童出生时患有先天性心脏病--一系列可能威胁生命的心脏结构和功能的问题。对于大多数儿童来说,这些可怕的缺陷的确切原因是未知的。罪魁祸首似乎是参与子宫内心脏形成的异常基因版本,或者说基因变体。但是,关于究竟哪些基因会导致先天性心脏病以及它们如何相互作用,仍有许多东西有待了解。
如今,在一项新的研究中,来自美国格拉德斯通研究所的研究人员开发出一种新方法,用于识别可能在先天性心脏病中发挥重要作用的基因变体,为加快研究这一严重疾病提供了机会。相关研究结果于2022年2月18日在线发表在Cell期刊上,论文标题为“Transcription factor protein interactomes reveal genetic determinants in heart disease”。论文通讯作者为格拉德斯通研究所所长Deepak Srivastava博士和格拉德斯通数据科学与生物技术研究所主任Katie Pollard博士。
这种结合了遗传学、计算生物学、干细胞生物学和蛋白质组学技术的新策略也可能应用于研究其他许多具有复杂遗传原因的疾病。
Srivastava说,“以前的方法产生了一长串在患者身上检测到的变体名单,但许多变体实际上被证明是不重要的,因此该领域的一个主要挑战是确定哪些变体是最重要的。我们的方法确定了最有可能参与疾病的变体,使我们能够专注于这些变体,加深对疾病的潜在生物学的理解,而且我们希望能够更迅速地迈向开发新的治疗方法。”
利用蛋白之间的相互作用
这种新策略不是孤立地研究变体,而是考虑蛋白之间的相互作用,以确定哪些变体可能导致疾病---在这项研究中,指的是先天性心脏病。
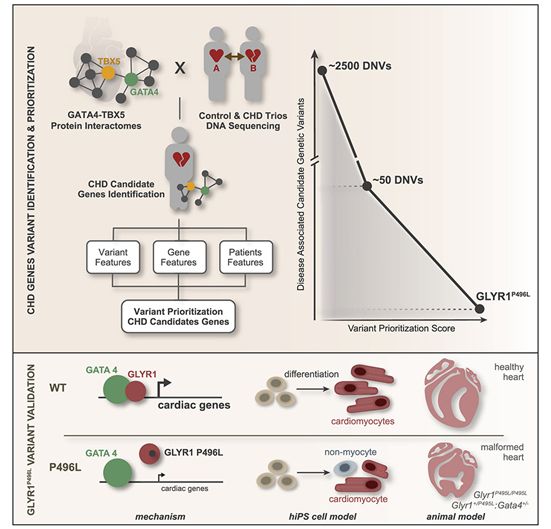
已知GATA4和TBX5蛋白是健康的人类心脏形成所必需的,并与其他蛋白合作以帮助心脏生长。从理论上讲,这个蛋白网络中其他蛋白的突变也可能导致心脏畸形。
为了确定这些潜在的罪魁祸首基因,这些作者利用从人类诱导性多能干细胞(ips)分化出的心脏细胞前体细胞(precursor heart cell),仔细绘制了GATA4和TBX5蛋白之间相互作用的整个网络。接下来,他们将这个由273个蛋白组成的蛋白网络与美国国家卫生研究院(NIH)资助的一个联盟开发的3000多名患有先天性心脏病的儿童及其父母的DNA测序数据进行交叉对比。
这些儿童测序数据中的几十个变体与也在GATA4-TBX5蛋白网络中发现的特定蛋白相匹配,这远远超过预期,使它们成为可能导致先天性心脏病的候选基因。
论文第一作者、Srivastava实验室博士后学者Bárbara González Terán博士说,“我们首先确定了受先天性心脏病影响的细胞类型中的重要蛋白网络,然后整合大规模的蛋白编码测序数据。许多科学家曾猜测这种方法是可行的,但据我们所知,这是第一次实际应用于任何一种疾病。”
发现新的排名靠前的变体
确定在GATA4-TBX5网络中鉴定出的每个候选变体是否真地促进心脏病,将涉及多年的研究。因此,在他们的新方法的最后一步,Pollard实验室研究生Maureen Pittman开发出一种根据促进先天性心脏病的可能性对候选变体进行排名的计算工具。这种排名算法考虑到了候选变体的特征、受影响的基因以及在携带候选变体的患者中发现的心脏缺陷类型。
Pittman说,“在我们用这种算法确定的排名最高的变体中,有些变体存在于已知会导致先天性心脏缺陷的基因中。但是许多基因以前从未与心脏发育有关,包括一种叫做GLYR1的蛋白,该蛋白参与了其他基因的开启和关闭。”
在细胞和小鼠中进行的其他实验表明,GLYR1确实在心脏形成中发挥着核心作用,而且患者携带的一种GLYR1变体通过阻碍它与GATA4的相互作用破坏了心脏发育。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.01.021。
Srivastava说,“确定GLYR1是心脏发育中的一个关键基因,为理解这个系统如何发挥作用开辟了一个全新的生物空间。我们将继续研究GLYR1的生物学特性,我们希望其他人能够跟进我们发现的其他排名靠前的变体。”
Srivastava指出,这项新研究不仅在很大程度上依赖于Pollard实验室开发的计算技术,而且还依赖于格拉德斯通研究所高级研究员Nevan Krogan博士所在实验室开发的蛋白质组学技术。Srivastava说,“格拉德斯通研究所充满活力和注重团队合作的努力真正使这项研究成为可能。”
研究复杂疾病的新工具
由于外科手术的进步,数以百万计的心脏缺陷儿童现在可以活到成年。但许多人仍然面临着终身的问题,如心力衰竭的风险增加。
González Terán说,“更好地了解先天性心脏病的遗传基础有潜力指出新的策略,不仅可以阻断这种疾病的产生(目前这非常具有挑战性),而且可以缓解手术后持续存在的问题,以改善生活质量和寿命。”
这些作者认为他们的新方法的力量在于它有望帮助阐明变体的组合---而不是单个变体本身---是如何共同导致先天性心脏病的。
Pollard说,“这种疾病很少是由单个基因引起的;比如,一个携带GLYR1变体的患者可能有从其父母那里遗传了其他变体,这些变体本身并不足以引起疾病,但却与GLYR1变体一起引起了疾病。我们的新方法可能有助于识别导致心脏缺陷的特定变体组合。”
这种方法也有潜力用来识别可能导致其他复杂疾病的变体组合。例如,Pollard团队已经在研究将它应用于神经发育疾病,包括自闭症和癫痫。
Srivastava说,“随着每年从复杂疾病患者那里产生越来越多的测序数据,我们的方法将有助于指导在所有检测到的变体中重点关注哪些变体。”(生物谷 Bioon.com)
参考资料:
Barbara Gonzalez-Teran et al. Transcription factor protein interactomes reveal genetic determinants in heart disease. Cell, 2022, doi:10.1016/j.cell.2022.01.021.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


