理化所新型碳基纳米材料的生物应用研究取得进展
来源:理化所 2021-03-18 12:25
癌症治疗是目前医学领域的难题,而癌细胞的扩散是癌症常见的死因。由于癌细胞迁移机制复杂,至今对其了解甚少。纳米金刚石由于其良好的生物相容性和易于被功能化修饰的特性,使其作为药物载体材料在生物医学领域具有广泛的应用。中国科学院理化技术研究所光电功能界面材料实验室自2010年开始研究基于纳米金刚石的癌症治疗体系,发现在酸性细胞环境内,纳米金
癌症治疗是目前医学领域的难题,而癌细胞的扩散是癌症常见的死因。由于癌细胞迁移机制复杂,至今对其了解甚少。纳米金刚石由于其良好的生物相容性和易于被功能化修饰的特性,使其作为药物载体材料在生物医学领域具有广泛的应用。
中国科学院理化技术研究所光电功能界面材料实验室自2010年开始研究基于纳米金刚石的癌症治疗体系,发现在酸性细胞环境内,纳米金刚石-顺铂体系可实现顺铂药物的缓释效果,能显着抑制HeLa细胞的增殖(Small 2010, 6, 1514-1519)。后续研究发现了高压高温法制备的纳米金刚石对HepG2细胞的迁移抑制效果(Physica Status Solidi A 2016, 213, 2131-2137)。特定浓度的羧基化纳米金刚石可显着抑制癌细胞中波形蛋白的表达,从而抑制HeLa和C6细胞的迁移(Diam Relat Mater 2020, 105, 107809)。近期,该课题组合成了纳米金刚石-二氧化钛复合材料,可在可见光下对癌细胞进行选择性杀伤,并抑制癌细胞的迁移。该研究为开发低毒性、多功能的光敏剂提供了新思路,在细胞诊疗与迁移方面具有潜在应用价值(Carbon 2021, 174, 90-97)。
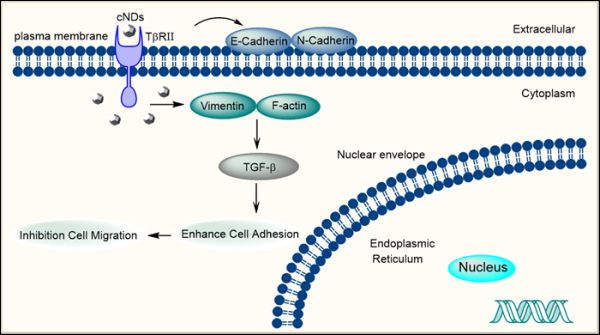
此外,该课题组还对纳米金刚石对肿瘤细胞迁移的抑制机制及其在体内的作用展开了深入探讨。结果表明,羧基化纳米金刚石可以提高肿瘤细胞与基底的粘附能力,从而导致细胞运动受限。在分子机理上主要表现在羧基化纳米金刚石能够下调N-钙粘蛋白和波形蛋白的表达,上调E-钙粘蛋白的表达,通过TGF-β信号通路逆转EMT过程。通过Phalloidin染色实验证实了羧基化纳米金刚石会损害F-肌动蛋白细胞骨架的组装,减少应力纤维和板状伪足的形成,进而抑制肿瘤细胞的迁移。利用小鼠肺转移模型验证了羧基化纳米金刚石在体内对肿瘤转移的抑制作用。未来,羧基化纳米金刚石有望作为简单的载体和探针,并在生物医学领域作为肿瘤细胞迁移的新型抑制剂,在调控细胞行为方面发挥积极作用。
相关研究成果以Nanodiamonds Inhibit Cancer Cell Migration by Strengthening Cell Adhesion: Implications for Cancer Treatment为题,在线发表在ACS applied Materials & Interfaces(2021,13,9620-9629)上。理化所研究员只金芳和副研究员李雷为论文通讯作者,博士研究生郭清越为论文第一作者,日本庆应义塾大学教授Yasuaki Einaga对该研究的实验设计和机理分析提供指导。研究工作得到国家自然科学基金、中科院国际合作研究基金和东南大学国家重点实验室开放研究基金的资助。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


