银屑病新药!优时比IL-17A/17F双效抑制剂bimekizumab头对头3期临床疗效击败Humira!
来源:本站原创 2020-11-05 16:01
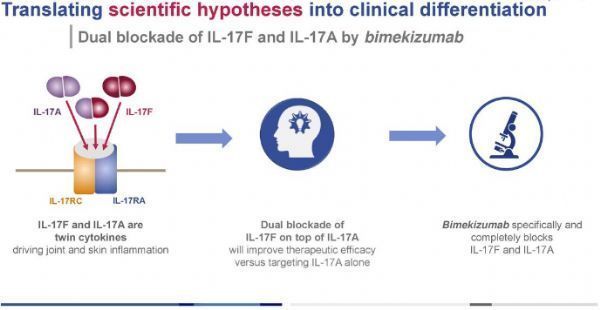
bimekizumab是一种具有双重作用机制的独特分子,可同时强效、选择性地中和IL-17A和IL-17F。

2020年11月05日讯 /生物谷BIOON/ --优时比(UCB)近日公布了评估新型抗炎药bimekizumab治疗中度至重度斑块型银屑病成人患者3期临床研究BE SURE的详细结果。这是一项头对头(head-to-head,H2H)研究,将bimekizumab与艾伯维旗舰产品Humira(修美乐,通用名:adalimumab,阿达木单抗)进行了比较。数据显示,研究达到了全部主要和次要终点:与Humira相比,接受bimekizumab治疗的患者皮损清除率更高。这些发现首次作为口头报告在10月底举行的欧洲皮肤病与性病学会(EADV)大会上公布。
bimekizumab是一种具有双重作用机制的独特分子,可同时强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。
BE SURE(NCT03412747)是一项随机、双盲、阳性药物对照III期研究,比较了bimekizumab与Humira治疗中度至重度斑块型银屑病成人患者的疗效和安全性。该研究包括一个24周的阳性药物对照初始治疗期,之后是盲法给药维持治疗期,直至第56周。研究共入组了478例患者,这些患者在筛查前慢性斑块型银屑病持续至少6个月,受影响体表面积至少为10%,PASI评分至少为12,研究者总体评估(IGA)五分制量表评分≥3分。研究的共同主要终点是治疗第16周的PASI90缓解(定义为:银屑病面积和严重程度指数至少改善90%)和IGA 0/1缓解(定义为:皮损完全清除或几乎清除并且相对基线至少有2分改善)。次要终点包括第24周和第56周时的PASI90和IGA 0/1、第16周和第24周时的PASI100。
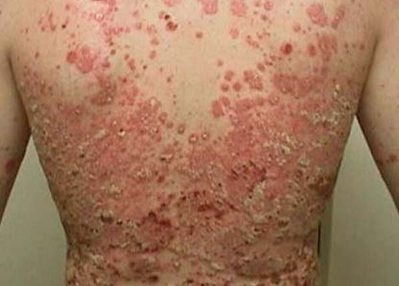
结果显示,研究达到了全部主要终点和次要终点。与Humira治疗的患者相比,接受bimekizumab治疗的患者在第16周的皮损清除率显著更高。在基线检查时开始使用bimekizumab的患者,有效率可维持一年。在第24周时,从Humira转为bimekizumab的患者皮损清除率迅速增加。bimekizumab的安全性和有效性尚未确定,也未得到世界任何监管机构的批准。
研究的具体数据为:在治疗第16周,与Humira组相比,bimekizumab治疗组有显著更高比例的患者达到PASI90缓解(86.2% vs 47.2%;p<0.001)和IGA 0/1缓解(85.3% vs 57.2%;p<0.001)。关键次要终点方面,治疗第16周和第24周,bimekizumab治疗组达到皮损完全清除(PASI100)的患者比例显著高于Humira组(第16周:60.8% vs 23.9%;第24周:66.8% vs 29.6%;均p<0.001)。
在2个bimekizumab研究组中,PASI90、PASI100和IGA 0/1的应答率一直维持到第56周。在2种给药方案中均观察到这些结果:bimekizumab每四周一次给药方案(Q4W)直到第56周,或Q4W给药16周、从第16周到第56周采用每8周一次给药方案(Q8W)。在接受Humira治疗的患者中,在第24周改用bimekizumab Q4W方案后,PASI90、PASI100和IGA 0/1的应答率迅速增加,并持续至第56周。在第56周,转换患者的应答率与那些在整个研究过程中一直使用bimekizumab治疗的患者具有可比性。
安全性方面,在第0-24周阳性药物对照期,治疗期间出现的不良事件(TEAE)和严重TEAE的发生率,在接受bimekizumab治疗的患者(分别为71.5%和1.6%)和接受Humira治疗的患者(分别为69.8%和3.1%)种具有可比性。在整个0-56周治疗期间,接受bimekizumab治疗的患者(包括那些从Humira转向bimekizumab治疗的患者)中,分别有81.4%和5.1%的患者经历了TEAE和严重TEAE。bimekizumab最常见的TEAE是鼻咽炎(20.9%)、口腔念珠菌病(16.2%)和上呼吸道感染(9.0%)。到第56周,接受bimekizumab治疗的患者没有出现自杀意念/行为、炎症性肠病或重大心脏不良事件。
BE SURE研究的调查员、英国曼彻斯特大学教授Richard Warren表示:“BU SURE研究结果显示,与治疗银屑病最常用的生物疗法之一的Humira相比,bimekizumab的皮损清除率显著提高。研究结果还显示了将接受Humira治疗的患者转向bimekizumab治疗的潜在益处。”
UCB免疫解决方案执行副总裁兼美国负责人Emmanuel Caeymaex表示:“BE SURE是bimekizumab银屑病临床开发项目中的第3个阳性研究,数据进一步证明了bimekizumab具有更优越的反应深度。这一结果也增加了越来越多的证据,除了IL-17A外,选择性抑制IL-17F对快速、彻底和持久的皮损清除具有的潜在价值。如果获得监管批准,UCB很自豪能为银屑病患者带来这一创新的解决方案。”
bimekizumab是一种新型人源化单克隆IgG1抗体,能强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。目前,bimekizumab正被评估治疗斑块型银屑病、银屑病关节炎(PsA)、强直性脊柱炎(AS)、非放射学中轴型脊柱关节炎(nr-axSpA)的治疗潜力,有望在2021年底获得首批顶线结果。
先前对银屑病和银屑病关节炎的早期临床研究表明,bimekizumab独特的IL-17A/IL-17F双重中和可能为治疗免疫介导的炎症性疾病提供一种新的靶向疗法。在疾病相关细胞中的临床前研究显示,在中和IL-17A的同时中和IL-17F能够减少皮肤和关节炎症以及病理性骨形成,其程度大于单独抑制IL-17A的程度。(生物谷Bioon.com)
原文出处:Bimekizumab Phase 3 Data Shows Superior Skin Clearance Over Humira[®] in Moderate-to-Severe Psoriasis Patients
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


