《癌细胞》:癌症液体活检新突破!血小板RNA谱可准确区分癌症种类和分期!
来源:奇点糕 2022-10-26 18:02
这项研究通过大样本的癌症数据发现源于血小板的RNA谱可有效诊断多种癌症,并实现了对癌症原始病灶的溯源。
众所周知,早期癌症和晚期癌症的生存预后相差甚大,在癌症早期阶段发现并及时治疗可显著改善癌症整体生存预后。近年来,以循环游离DNA(cfDNA)为研究核心的液体活检技术在癌症筛查中具有重要作用[1],但在癌症的早期阶段,患者血浆中cfDNA含量较低[2]。因此,开发新的液体活检指标对于癌症早筛和预后改善至关重要。
血小板在血液中大量存在且易于分离,除了正常的凝血功能以外,其在炎症性疾病发生、癌症进展和转移中的作用也得到了广泛的研究,可作为癌症检测的可靠生物来源。
既往研究表明,血小板可分离出肿瘤来源的RNA,肿瘤也可以通过改变血小板的RNA谱来诱导血小板,而被肿瘤诱导的血小板(TEP)衍生的RNA谱可能具特异性,或可用来作为局部和转移性癌症的辅助诊断方法。
近期,荷兰阿姆斯特丹癌症中心和液体活检中心Thomas Wurdinger和Myron G. Best教授领衔的研究团队在Cancer Cell上表了一项重要研究成果。他们发现,利用TEP衍生的RNA表达谱可检测出18种癌症,相比于健康对照,具有99%的特异性,且对多个阶段的肿瘤都具有较高的诊断价值[5]。

图1. 文章首页截图
为精确计算血小板RNA谱诊断癌症的能力,研究人员通过迭代建模的方法构建了泛癌thromboSeq算法模型,并在此算法上进行优化,以期达到可溯源癌症原始病灶的能力(图2)。
研究人员先是对血小板RNA测序后进行严格的质量控制,最后从13个机构中纳入了2351个人的血小板样本,包括1628例癌症患者样本(涵盖18种肿瘤)、390例健康人样本、333例炎性疾病/心血管疾病/良性肿瘤患者样本,进行后续分析。
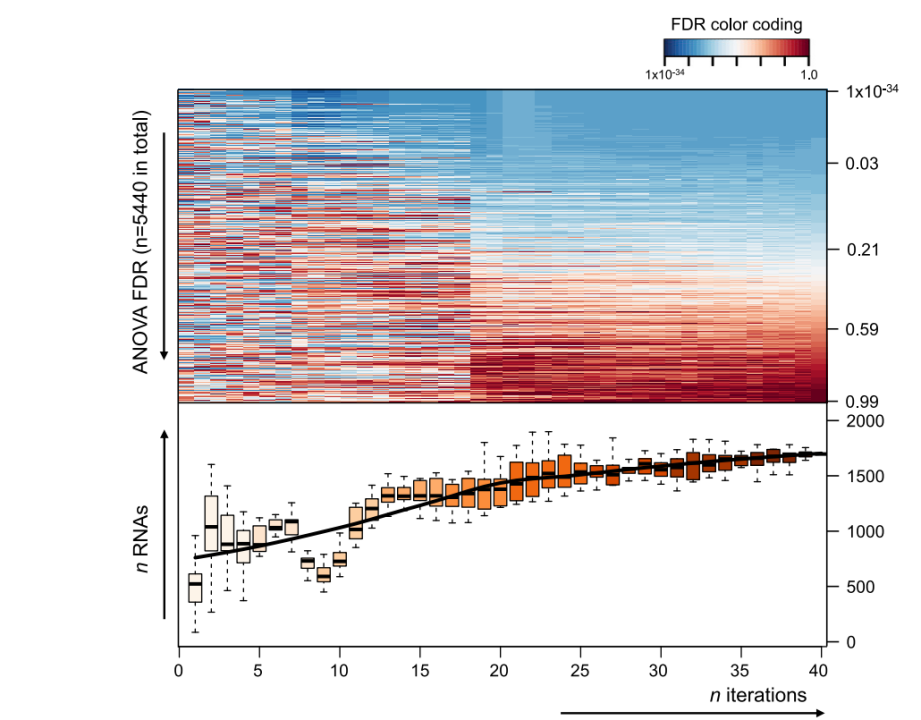
图2. 泛癌算法模型
基于这个算法模型,研究人员想知道是否可以利用TEP衍生RNA谱开发一种可早期特异性检测癌症的方法,起到准确诊断癌症的作用。
于是研究人员对计算模型进行了评估和大样本验证,其中使用391例样本用于模型构建,385例样本用于模型评估;1575例(包含1096名癌症患者样本、146名健康人群样本及333例非癌症疾病患者样本)样本用于模型验证。
然而,当研究人员以非癌症疾病(炎症/心血管疾病/良性肿瘤患者的血液样本)作为对照时,检测特异性就降低至78%(图3D)。这说明患者的潜在疾病可能会影响检测的准确性。
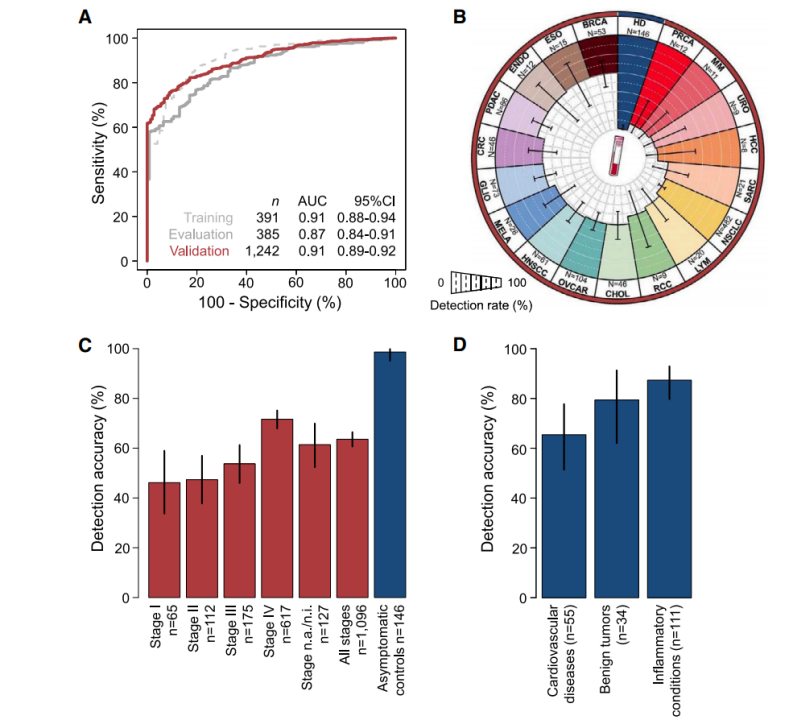
图3. 血小板RNA谱对诊断肿瘤的准确率
随后,为检测构建的计算模型是否具有普遍性,研究人员从验证组中挑选了两个代表性机构的患者样本(样本贡献较多的机构13和样本贡献较少的机构3)进行了亚组分析,发现这个算法模型对机构13和机构3的各病理分期的癌症患者检出率相似(图4),表明这种泛癌测试模型具有普遍性。
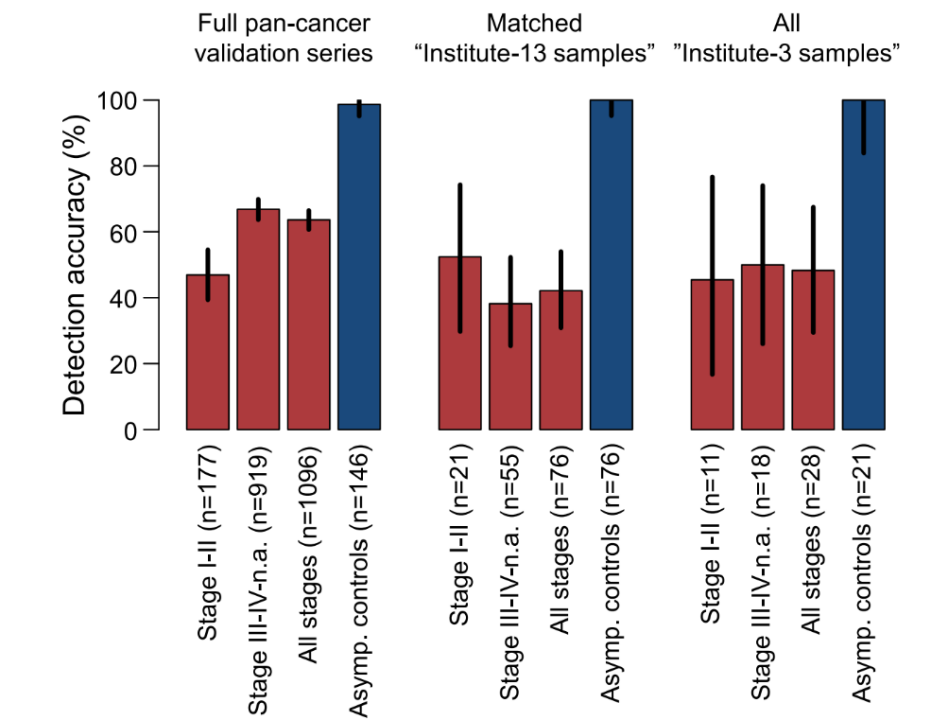
图4. 血小板RNA谱在不同机构癌症患者中的检出率
由此可见,这个基于血小板RNA谱的检测模型具有很高的诊断效能。但在癌症早期诊断过程中,如何特异性诊断某一种癌症,也是一个需要解决的问题。
研究人员通过纳入1025例原发肿瘤患者的血液样本,并根据肿瘤类型进行分组(522例非小细胞肺癌、144例卵巢癌、132例神经胶质瘤、126例胰腺癌及101例头颈部癌样本),然后构建“肿瘤来源血小板RNA谱交叉验证算法模型”,实现对肿瘤原始病灶的溯源。
结果表明,通过“肿瘤来源血小板RNA谱交叉验证算法模型”诊断神经胶质瘤、头颈部癌、非小细胞肺癌、卵巢癌及胰腺癌的准确率分别达79%、65%、82%、45%及28%(图5A,C)。此外,在5个肿瘤类型的每个肿瘤分期检测中,该算法在晚期肿瘤中检测的准确性最佳,I-III期准确率为75%,IV期准确率为89%(图5B)。
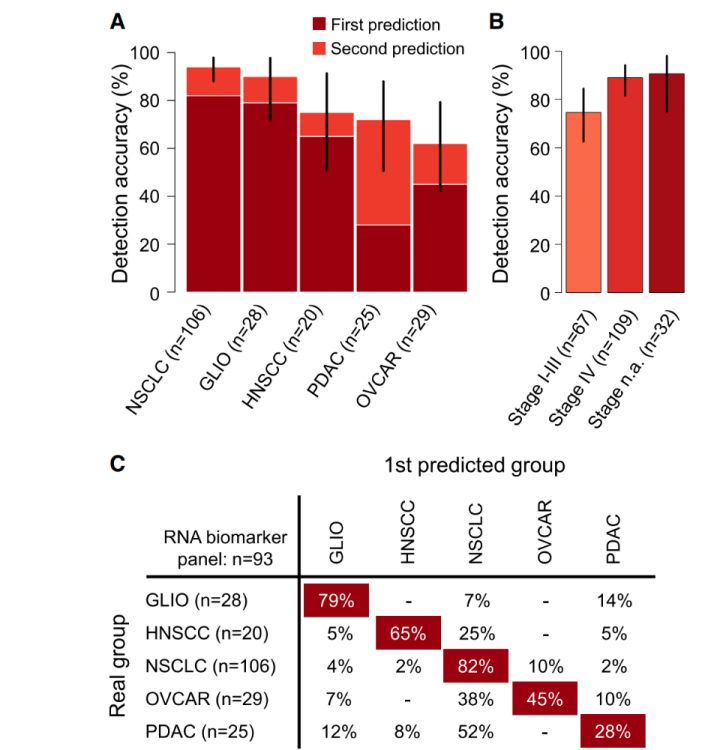
图5. 血小板RNA谱诊断肿瘤来源模型效能
由于血小板分布具有全身性,血小板RNA谱在诊断时不可避免地会遇到一个问题,即转移到某个器官肿瘤的血小板RNA谱是否与这个器官原发肿瘤的血小板RNA谱有区别?这会直接影响到血小板RNA谱在诊断肿瘤来源中的可靠性。
基于这个问题,研究人员分析了132例胶质瘤患者、93例脑转移患者、299例转移性肿瘤患者(由非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌、食管癌、胰腺癌及肾细胞癌转移至其他器官,包括转移至脑部的93例患者)样本的血小板RNA谱评分,并发现颅内肿瘤与颅外肿瘤的血小板RNA谱具有明显的区别,而原发性肿瘤伴脑转移样本的评分介于两者之间(图5)。这表明,对于脑转移患者而言,血小板RNA谱很有可能会受到受到原发肿瘤和转移瘤两方面的影响。
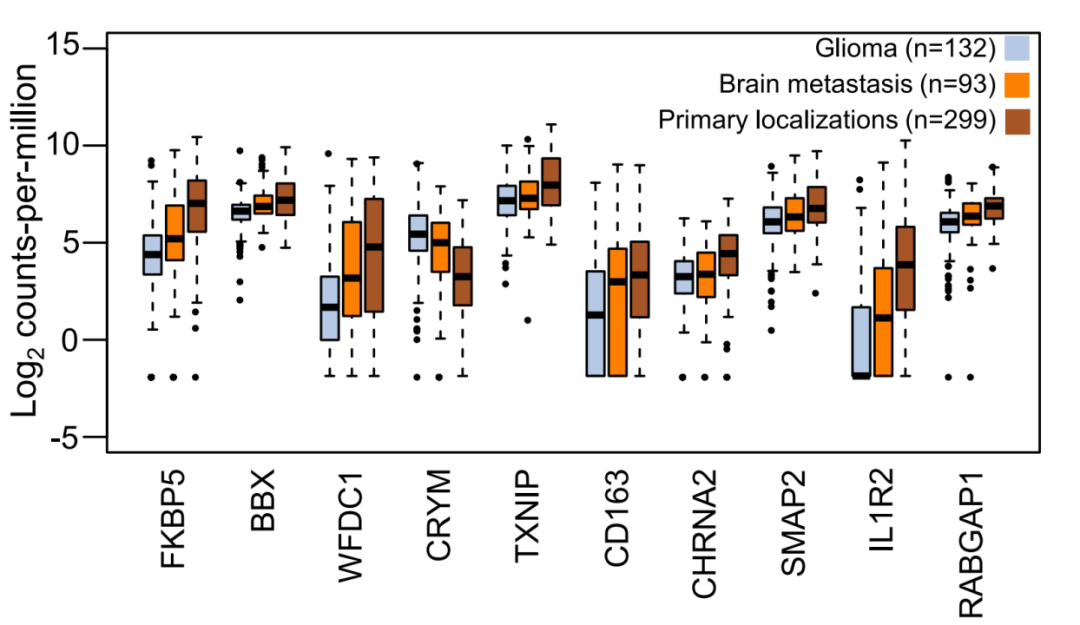
图6. 脑转移患者、原发性脑肿瘤和其他部位肿瘤血小板谱的区别
总之,这项研究通过大样本的癌症数据发现源于血小板的RNA谱可有效诊断多种癌症,并实现了对癌症原始病灶的溯源。这项研究对液体活检是一个重要的补充,对于癌症早筛具有很重要的指导意义,至于该方法是否能取代游离循环肿瘤细胞(CTC)成为最有前景的液体活检技术,还需要更多证据验证才行。
参考文献:
[1] Sabrkhany S, Kuijpers MJE, Griffioen AW, et al. Platelets: the holy grail in cancer blood biomarker research? Angiogenesis. 2019 Feb;22(1):1-2. doi: 10.1007/s10456-018-9651-4.
[2] Heitzer E, Haque IS, Roberts CES, et al. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nat Rev Genet. 2019 Feb;20(2):71-88. doi: 10.1038/s41576-018-0071-5.
[3] In 't Veld SGJG, Wurdinger T. Tumor-educated platelets. Blood. 2019 May 30;133(22):2359-2364. doi: 10.1182/blood-2018-12-852830.
[4] Shen Y, Lai Y, Xu D, et al. Diagnosis of thyroid neoplasm using support vector machine algorithms based on platelet RNA-seq. Endocrine. 2021 Jun;72(3):758-783. doi: 10.1007/s12020-020-02523-x.
[5] In 't Veld SGJG, Arkani M, Post E, et al. Detection and localization of early- and late-stage cancers using platelet RNA. Cancer Cell. 2022 Sep 12;40(9):999-1009.e6. doi: 10.1016/j.ccell.2022.08.006.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


