Cell:哈佛大学卢坤平团队提出消除肿瘤新方法,这个基因不容忽视
来源:丁香学术 2021-08-16 12:10
胰腺癌是著名的「癌症之王」,其发病病程短、恶化速度快、死亡率高,不仅化疗、靶向治疗对它效果不佳,就连近年来最为火热的免疫治疗也对它束手无策。因此,发现一种让胰腺癌对化疗或免疫治疗更敏感的方法可能可以作为胰腺癌治疗的新策略。来自哈佛大学医学院的卢坤平教授团队在 Cell上在线发表了题为 Targeting Pin1 renders pa
胰腺癌是著名的「癌症之王」,其发病病程短、恶化速度快、死亡率高,不仅化疗、靶向治疗对它效果不佳,就连近年来最为火热的免疫治疗也对它束手无策。
因此,发现一种让胰腺癌对化疗或免疫治疗更敏感的方法可能可以作为胰腺癌治疗的新策略。
来自哈佛大学医学院的卢坤平教授团队在 Cell上在线发表了题为 Targeting Pin1 renders pancreatic cancer eradicable by synergizing with immunochemotherapy 的研究成果 。
该研究发现靶向 Pin1 可以与化疗以及免疫治疗药物发挥协同作用,根除小鼠体内的肿瘤,为胰腺癌治疗提供了潜在的新思路。
本文的通讯作者卢坤平教授曾在国际上首先发现一系列新的基因家族,以他个人名字分别命名为 Pin1 至 Pin3 以及 PinX1 至 PinX4,这一系列基因家族的结构和功能得到国际公认 [2],本文的主角 Pin1 便是其中之一。
研究内容
先前已有一些研究表明 Pin1 具有很强的促癌功能,然而,目前尚不清楚 Pin1 是否在肿瘤微环境和癌症免疫治疗中发挥作用。
作者通过免疫组化评估了 167 例胰腺导管癌(Pancreatic ductal adenocarcinoma, PDAC)患者肿瘤组织中 Pin1 的表达情况,结果发现 Pin1 在癌细胞中显着高表达,并与肿瘤进展正相关。
此外,在肿瘤间质的癌症相关成纤维细胞(cancer-associated fibroblasts, CAFs)中,Pin1 也显着高表达。同时,Pin1 的高表达与免疫抑制型的肿瘤微环境,以及胰腺癌患者的低生存率密切相关。
那么,癌细胞和 CAFs 中高表达的 Pin1 又是通过什么机制发挥功能的呢?
先前的研究发现,Pin1 是一种独特的脯氨酸异构酶,在各种癌症中,Pin1 的过度活化可以通过激活 60 多个癌蛋白,并使 30 多个肿瘤抑制因子失活,从而促进肿瘤的发生 [3, 4]。
研究人员通过抑制 Pin1,观察到受 Pin1 调控的多种促癌蛋白的表达都显着降低,癌细胞和 CAFs 分泌的 IL-6、TGF-β 等多种促进肿瘤发展的细胞因子同样也显着降低。此外,研究人员还发现,敲除了 CAFs 中的 Pin1 后,CAFs 对肿瘤生长和恶性程度发展的促进作用也消失了。
随后,研究人员用 Pin1 抑制剂进行预处理,发现其可以增强胰腺导管癌细胞对化疗药物吉西他滨(gemcitabine, GEM)以及免疫检查点抑制剂 PD-1 单抗的敏感性。
这一作用背后的机制又是怎样的呢?细胞摄取吉西他滨需要平衡型核苷转运蛋白 1(ENT1)的参与,ENT1 也是吉西他滨治疗反应的标记物。后续研究发现,通过抑制 Pin1 可以显着增加 ENT1 蛋白表达水平。同时,PD-1 的配体 PD-L1 的表达水平也显着升高。
接下来,研究人员进一步探究了 Pin1 影响 ENT1 和 PD-L1 两者表达的具体机制。他们观察到,抑制 Pin1 后 PDAC 细胞中 PD-L1 和 ENT1 蛋白水平虽然增加,但是它们的 mRNA 水平却降低了,表明抑制 Pin1 可能提高了 ENT1 和 PD-L1 蛋白的稳定性。
在抑制溶酶体降解通路后,PD-L1 和 ENT1 的表达显着升高,提示 Pin1 可能是通过调节溶酶体降解通路,进而对 PD-L1 和 ENT1 进行调控的。
先前研究发现, HIP1R 蛋白可以促进 PD-L1 的溶酶体降解 [5],同时 HIP1R 蛋白还存在 Pin1 的潜在底物识别位点。进一步的机制研究发现,Pin1 可能通过作用于 HIP1R 中的 pSer929-Pro 位点来促进肌动蛋白结合,进而促进 PD-L1 和 ENT1 的溶酶体降解过程。
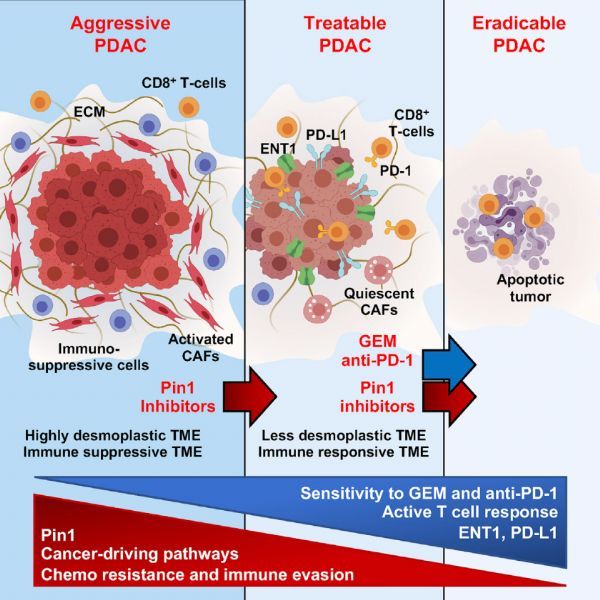
为了确定 Pin1 抑制剂是否能够破坏免疫抑制的肿瘤微环境,并通过与免疫化疗相结合根除原发性 PDAC 肿瘤,研究人员使用了在胰腺中发生 KrasG12D 和 p53R172H 突变的 KPC 小鼠。这些小鼠表现出 PDAC 肿瘤的异质性、免疫抑制的肿瘤微环境、低免疫原性和胰腺癌典型的快速进展。
研究人员用 Pin1 抑制剂、GEM 和 PD-1 单抗(G+P)或它们的组合使用对KPC 小鼠进行治疗。结果显示,G+P 既不影响免疫抑制的肿瘤微环境,也不增加小鼠的生存率,大多数小鼠在 3 个月内死亡。
然而,Pin1 抑制剂和 G+P 联合使用可以抑制癌细胞的增殖,以及 CAF 的激活和增殖,破坏了免疫抑制的肿瘤微环境,增加了肿瘤中杀伤性 T 细胞的浸润,并诱导 PD-L1 和 ENT1 在癌细胞中的表达。
重要的是,Pin1 抑制剂和 G+P 联合使用显着提高了生存率,60% - 70% 的小鼠在治疗后至少存活了 6 个月。经尸检,幸存的小鼠肉眼无明显肿瘤,仅显微镜下可见残留肿瘤,且没有发生肝转移,表明尽管胰腺中致癌突变体 Kras 和 p53 仍在持续表达,但肿瘤正在消失。
综上结果表明,靶向 Pin1 不仅可以抑制多种癌症通路的激活,还可以通过诱导细胞表面 PD-L1 和 ENT1 的表达,进而协同化疗以及免疫药物治疗,从多个角度发挥消除肿瘤的作用。
研究总结
本研究发现 Pin1 在胰腺癌细胞,和肿瘤间质的癌症相关成纤维细胞(CAFs)中都过表达,并与患者更差的生存率相关。靶向 Pin1 可通过作用于 HIP1R 提高 ENT1 和 PD-L1 在癌细胞中的表达水平,进而增强化疗药物和免疫检查点抑制剂的对胰腺癌的治疗效果。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。