Redox Biology:G蛋白β5-atm复合物驱动扑热息痛肝毒性
来源:生物谷 2021-05-11 17:56
2021年5月10日讯/生物谷BIOON/---印度桑贾伊·甘地医学研究生院在“RedoxBiology”杂志发表了题为G protein β5-ATM complexes driveacetaminophen-induced hepatotoxicity的文章。G蛋白β5-atm复合物驱动扑热息痛肝毒性。该研究为Gβ5在肝脏中的新的、非G蛋白依赖的作用提供
2021年5月10日讯/生物谷BIOON/---印度桑贾伊·甘地医学研究生院在“Redox
Biology”杂志发表了题为G protein β5-ATM complexes drive
acetaminophen-induced hepatotoxicity的文章。G蛋白β5-atm复合物驱动扑热息痛肝毒性。该研究为Gβ5在肝脏中的新的、非G蛋白依赖的作用提供了一个可行的解释。G-β5在导致急性胰腺炎依赖性肝损伤的多种病理后遗症中处于关键节点。
扑热息痛(乙酰对氨基酚,APAP)是用于治疗轻度疼痛和发烧的众多处方和非处方药中的活性成分。尽管人们普遍认为APAP过量是安全有效的,但在美国和欧洲,APAP过量,无论是故意的还是意外的,都是导致急性肝功能衰竭(ALF)的主要原因。将APAP剂量限制在每天不超过4000毫克通常足以防止严重的肝脏损伤。然而,年龄、遗传、营养不良、饮酒和潜在的肝病等因素可以改变最大耐受的APAP剂量。
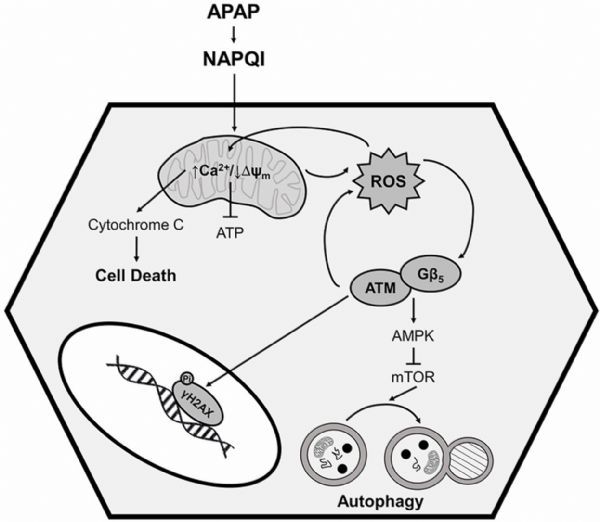
尽管对APAP引起的肝脏毒性的研究已经跨越了几十年,但其潜在的机制仍然知之甚少。摄入的APAP绝大多数是葡萄糖醛酸化或硫酸化,并迅速排出。然而,一小部分被肝细胞色素P450酶代谢成高活性的中间体n -乙酰-对苯醌亚胺(NAPQI),通常通过谷胱甘肽(GSH)偶联解毒。在APAP肝损伤的最初阶段,NAPQI耗尽谷胱甘肽储存,并将巯基加合物添加到细胞蛋白中。由此产生的氧化应激、线粒体解偶联、三磷酸腺苷(ATP)耗竭和c-jun氨基末端(Jnk)激活最终导致肝细胞坏死。急性损伤后,通过自噬去除受损的蛋白质和细胞器来维持细胞活力,并允许肝再生。的确,药物诱导自噬可以减轻APAP引起的肝毒性。目前,用N-乙酰-L-半胱氨酸(NAC)替代谷胱甘肽仍是治疗APAP过量的唯一有效方法。然而,该疗法仅在摄入APAP后8 12小时内有效,对后期出现或长期摄入高水平APAP的患者几乎没有缓解作用。因此,研究APAP介导的肝损伤的后期、下游病理机制对于开发更有效的治疗方法至关重要。
小鼠肝脏特异性的Gβ5基因敲除可保护肝脏免受急性或慢性APAP给药后的肝纤维化、细胞丢失、氧化应激和炎症的影响。反之,肝组织中G-β-5的过度表达足以导致肝细胞功能障碍和丢失。在肝细胞中,GATP 5的缺失可以改善线粒体功能障碍,维持β的生成,减轻APAP诱导的细胞死亡。此外,Gβ5基因敲除也逆转了APAP对激酶级联的影响(如atm/ampk),信号传递给哺乳动物的雷帕霉素靶(MTor),雷帕霉素是自噬的主要调节者,因此中断了自噬通量。虽然ATM通常被归入核DNA修复途径,但它在细胞质中也起着控制细胞死亡和自噬的作用。事实上,作者证明Gβ5与atm的脂肪域形成一个直接、稳定的复合体,对自身磷酸化依赖的激酶激活很重要。
在此,作者认为肝G-β-5是急性胰腺炎所致肝毒性的关键驱动因素。作者在暴露于中毒水平的APAP的小鼠组织和细胞、人肝细胞和肝组织样本中检测到G-β-5蛋白上调。G-β5基因敲除影响了导致APAP依赖性肝损伤的几个关键细胞过程,包括线粒体功能、氧化应激、自噬和细胞死亡。因此,G-β-5在APAP介导的肝损伤中成为一个可行的药物靶点。(生物谷 Bioon.com)
参考资料:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。