PNAS:识别特定类型短糖链的CAR-T细胞有望治疗一系列实体瘤
来源:本站原创 2020-07-06 22:36
2020年7月6日讯/生物谷BIOON/---一种称为CAR-T细胞疗法的方法已经成功地用于治疗淋巴瘤和白血病等血癌患者。它通过添加一种能识别癌细胞表面独特特征的抗体片段来对患者自身的T细胞进行基因改造。在一项新的研究中,来自美国伊利诺伊大学厄本那香槟分校、芝加哥大学和丹麦哥本哈根大学的研究人员报道,他们极大地拓宽了这种方法的潜在靶标:他们的经过基因改造的T
2020年7月6日讯/生物谷BIOON/---一种称为CAR-T细胞疗法的方法已经成功地用于治疗淋巴瘤和白血病等血癌患者。它通过添加一种能识别癌细胞表面独特特征的抗体片段来对患者自身的T细胞进行基因改造。在一项新的研究中,来自美国伊利诺伊大学厄本那香槟分校、芝加哥大学和丹麦哥本哈根大学的研究人员报道,他们极大地拓宽了这种方法的潜在靶标:他们的经过基因改造的T细胞可以攻击来自人类和小鼠的各种实体瘤癌细胞。相关研究结果发表在2020年6月30日的PNAS期刊上,论文标题为“Structure-guided engineering of the affinity and specificity of CARs against Tn-glycopeptides”。
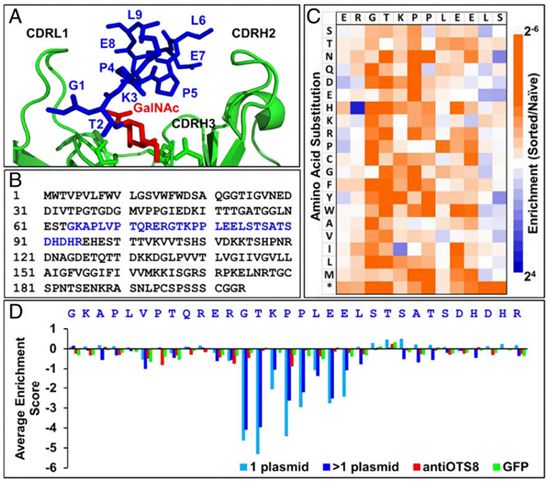
论文通讯作者、伊利诺伊大学厄本那香槟分校博士后研究员Preeti Sharma说,“癌细胞在其表面表达某些蛋白,这些蛋白是由于不同种类的突变而产生的。在这项研究中,我们正在研究附着某些短糖链的蛋白靶标。”
Sharma说,某些类型的癌细胞表面上异常短的糖链是由突变导致的,这些突变破坏了将这些糖链连接到蛋白上的分子途径。与这些异常的糖链结合的药物可以优先识别癌细胞,放过健康细胞。
CAR-T细胞疗法对某些类型的血癌患者来说是一种很有前途的治疗方法。伊利诺伊大学厄本那香槟分校生物化学教授David Kranz博士说,但识别实体肿瘤中的结合位点一直比较困难。他说,“这个领域的一个主要挑战鉴定存在于实体瘤中癌细胞表面上而不存在于正常组织上的靶标。”
这些作者从一种可以作为受体的抗体片段开始这项研究。已知这种抗体可以与小鼠实体瘤癌细胞表面上的蛋白连接在一起的一种特殊类型的异常糖链相互作用。
Sharma说,“我们意识到,由于这种受体能与癌细胞表面上的蛋白和糖链结合,因此可能有机会改变这种抗体,使之能与连接这种短糖的不止一种蛋白结合。这可能使得它对不同种类的癌症具有广泛的反应性。”
论文共同作者、Kranz实验室博士后研究员Qi Cai测试了这种异常短糖链附近的氨基酸序列变化是否会影响这种受体对这个位点的结合。这使得这些作者能够确定这否可以稍微改变这种抗体以适应其他的糖连接的癌症靶标。
Sharma说,他们进行了一系列的突变实验,专注于这种抗体的必需部分。她说,“我们产生了这种受体的将近100万个突变版本,然后我们对它们进行筛选,以找到我们想要的特性。在这项研究中,我们希望扩大这种抗体的特异性,使之不仅能对小鼠靶标做出反应,而且还能对人类靶标做出反应。”
一旦他们找到了具有理想特性的抗体,这些作者就对T细胞进行基因改造使之表达这些抗体,并用小鼠和人类癌细胞系对这些经改造后表达它们的T细胞进行测试。
Sharma说,“我们的经过改造的T细胞显示出抵抗人类和小鼠癌细胞系的活性。而且这些T细胞如今可以识别几种不同的附着有短糖链的蛋白。这真地很重要,这是因为在癌症治疗中,大多数时候你都是在追寻癌细胞表面上的单个靶标。有了多个靶标,癌症就很难逃避治疗。”
Kranz说,“虽然这些经过基因改造的T细胞处于开发初始阶段,但是我们特别兴奋的是我们可以使用相同的T细胞产品来自研究小鼠和人类癌症的疗效和安全性。”(生物谷 Bioon.com)
参考资料:
1.Preeti Sharma et al. Structure-guided engineering of the affinity and specificity of CARs against Tn-glycopeptides. PNAS, 2020, doi:10.1073/pnas.1920662117.
2.Engineered immune cells recognize, attack human and mouse solid-tumor cancer cells
https://medicalxpress.com/news/2020-06-immune-cells-human-mouse-solid-tumor.html

图片来自PNAS, 2020, doi:10.1073/pnas.1920662117。
论文通讯作者、伊利诺伊大学厄本那香槟分校博士后研究员Preeti Sharma说,“癌细胞在其表面表达某些蛋白,这些蛋白是由于不同种类的突变而产生的。在这项研究中,我们正在研究附着某些短糖链的蛋白靶标。”
Sharma说,某些类型的癌细胞表面上异常短的糖链是由突变导致的,这些突变破坏了将这些糖链连接到蛋白上的分子途径。与这些异常的糖链结合的药物可以优先识别癌细胞,放过健康细胞。
CAR-T细胞疗法对某些类型的血癌患者来说是一种很有前途的治疗方法。伊利诺伊大学厄本那香槟分校生物化学教授David Kranz博士说,但识别实体肿瘤中的结合位点一直比较困难。他说,“这个领域的一个主要挑战鉴定存在于实体瘤中癌细胞表面上而不存在于正常组织上的靶标。”
这些作者从一种可以作为受体的抗体片段开始这项研究。已知这种抗体可以与小鼠实体瘤癌细胞表面上的蛋白连接在一起的一种特殊类型的异常糖链相互作用。
Sharma说,“我们意识到,由于这种受体能与癌细胞表面上的蛋白和糖链结合,因此可能有机会改变这种抗体,使之能与连接这种短糖的不止一种蛋白结合。这可能使得它对不同种类的癌症具有广泛的反应性。”
论文共同作者、Kranz实验室博士后研究员Qi Cai测试了这种异常短糖链附近的氨基酸序列变化是否会影响这种受体对这个位点的结合。这使得这些作者能够确定这否可以稍微改变这种抗体以适应其他的糖连接的癌症靶标。
Sharma说,他们进行了一系列的突变实验,专注于这种抗体的必需部分。她说,“我们产生了这种受体的将近100万个突变版本,然后我们对它们进行筛选,以找到我们想要的特性。在这项研究中,我们希望扩大这种抗体的特异性,使之不仅能对小鼠靶标做出反应,而且还能对人类靶标做出反应。”
一旦他们找到了具有理想特性的抗体,这些作者就对T细胞进行基因改造使之表达这些抗体,并用小鼠和人类癌细胞系对这些经改造后表达它们的T细胞进行测试。
Sharma说,“我们的经过改造的T细胞显示出抵抗人类和小鼠癌细胞系的活性。而且这些T细胞如今可以识别几种不同的附着有短糖链的蛋白。这真地很重要,这是因为在癌症治疗中,大多数时候你都是在追寻癌细胞表面上的单个靶标。有了多个靶标,癌症就很难逃避治疗。”
Kranz说,“虽然这些经过基因改造的T细胞处于开发初始阶段,但是我们特别兴奋的是我们可以使用相同的T细胞产品来自研究小鼠和人类癌症的疗效和安全性。”(生物谷 Bioon.com)
参考资料:
1.Preeti Sharma et al. Structure-guided engineering of the affinity and specificity of CARs against Tn-glycopeptides. PNAS, 2020, doi:10.1073/pnas.1920662117.
2.Engineered immune cells recognize, attack human and mouse solid-tumor cancer cells
https://medicalxpress.com/news/2020-06-immune-cells-human-mouse-solid-tumor.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


