Science子刊:癌症治疗新策略!靶向坏死性凋亡可诱导免疫系统杀死肿瘤
来源:本站原创 2019-06-22 12:17
2019年6月22日讯/生物谷BIOON/---每天,人体内数十亿个细胞通过激活一种称为细胞凋亡(apoptosis)的细胞自杀程序,以一种有序的方式默默死亡。但是,其他的细胞,通常在它们遭受病毒感染时,会选择更混乱、更暴力的形式:坏死性凋亡(necroptosis),即利用免疫系统攻击并杀死身体自身的细胞。近年来,生物学家已开始研究在癌细胞中激活坏死性凋亡是否会同样地诱导免疫系统攻击肿瘤。如今,
2019年6月22日讯/生物谷BIOON/---每天,人体内数十亿个细胞通过激活一种称为细胞凋亡(apoptosis)的细胞自杀程序,以一种有序的方式默默死亡。但是,其他的细胞,通常在它们遭受病毒感染时,会选择更混乱、更暴力的形式:坏死性凋亡(necroptosis),即利用免疫系统攻击并杀死身体自身的细胞。
近年来,生物学家已开始研究在癌细胞中激活坏死性凋亡是否会同样地诱导免疫系统攻击肿瘤。如今,在一项新的研究中,来自美国华盛顿大学和罗格斯大学的研究人员发现将经历坏死性凋亡的细胞(即坏死性凋亡细胞)注入小鼠的肿瘤中会引导杀伤性T细胞攻击恶性肿瘤并减缓其生长。此外,他们发现让肿瘤细胞表达一种诱导坏死性凋亡产生的酶足以启动肿瘤缩小过程---他们认为这种策略可能能够提高现有免疫疗法的疗效。相关研究结果发表在2019年6月21日的Science Immunology期刊上,论文标题为“Intratumoral activation of the necroptotic pathway components RIPK1 and RIPK3 potentiates antitumor immunity”。
英国癌症研究中心比森研究所癌症细胞生物学家Stephen Tait(未参与这项新的研究)评论道,“它增加了更多的证据表明在癌症中[靶向]这种类型的细胞死亡是一件好事:它会引发抗肿瘤免疫反应。它为靶向或激活这种通路作为癌症疗法提供了强有力的理由。”
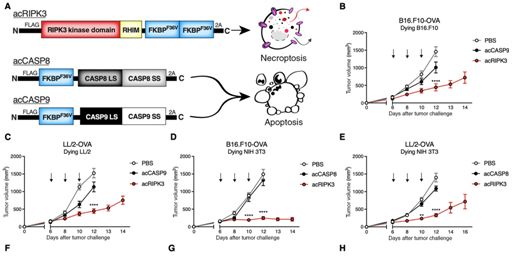
为了研究坏死性凋亡细胞对肿瘤的影响,华盛顿大学博士生Annelise Snyder和她的同事们对癌细胞进行基因改造,使得RIPK3蛋白---一种触发坏死性凋亡的酶---被激活。她将这些经过基因改造的癌细胞注射到小鼠腹侧的黑色素瘤或腺癌中。在接下来的一周内,他们观察到这些小鼠的肿瘤生长减慢---经后来发现,这一过程依赖于杀伤性T细胞的存在。重要的是,这些小鼠的存活时间显著长于接受细胞凋亡诱导性酶(apoptosis-inducing enzyme, 也译作诱导细胞凋亡的酶)受到激活的癌细胞注射的小鼠。
在第一项实验中,注射的坏死性凋亡细胞来源于与肿瘤相同的细胞系,并携带相同的细胞表面抗原。但是,令这些研究人员吃惊的是,当他们将来自健康成纤维细胞系的坏死性凋亡细胞注入肿瘤中时,他们观察到肿瘤生长发生同样的减缓。对论文通讯作者、华盛顿大学癌症免疫学家Andrew Oberst来说,这些坏死性凋亡细胞不需要携带任何肿瘤抗原就能产生这种效果,这是一个了不起的发现。
对他来说,这表明坏死性凋亡细胞不是通过展示特定的抗原来指导T细胞靶向肿瘤,而是通过分泌特定的细胞因子和趋化因子来激活位于肿瘤周围的局部T细胞,并且这些T细胞已作好准备攻击这些癌细胞,但需要外部推动才能变得活跃。Oberst 表示,“位置就是一切。通过引入坏死性凋亡细胞让肿瘤微环境发生这种变化. . .是真正能让它发挥作用的原因。”
Oberst实验室之前的研究(Science, 2015, doi:10.1126/science.aad0395)已表明酶RIPK3可以驱动细胞在细胞死亡过程中产生炎性趋化因子和细胞因子,从而激活杀伤性T细胞。
进一步的实验似乎支持细胞因子和趋化因子在激活免疫系统中的重要性。比如,当这些研究人员处理坏死性凋亡细胞以减少这些细胞因子的产生,然后将它们注射到肿瘤中时,他们没有观察到他们在早期实验中观察到的生长减缓。这是令人吃惊的,这是因为人们长期以来认为坏死性凋亡本身会激发免疫系统。然而,“实际上并不是细胞死亡本身,而是细胞的破裂,才是关键事件”,他补充道,“如果我们只是诱导细胞裂解,我们看不到同样的效果。”
比利时根特癌症研究所癌症生物学家Dmitri Krysko(未参与这项新的研究)在电子邮件中表示,“这是一项非常出色和优雅的研究。”他说,那些坏死性凋亡癌细胞产生的免疫反应已经为人所知---正如他的实验室和其他人所表明的那样,但所涉及的机制在很大程度上尚未被人探究。
他写道,相比于诱导细胞凋亡,触发坏死性凋亡被认为是一种更有吸引力的策略,这些因为许多肿瘤会产生阻断或逃避细胞凋亡的方法。然而,“需要强调的是,许多癌症往往也会对坏死性凋亡产生抵抗力。”比如,已知几种癌细胞系和癌症(比如乳腺癌和急性髓性白血病)会失去RIPK3的表达,他补充道。
在进一步的实验中,Oberst和他的团队探索了一种解决这个问题的方法:如果他们能够将酶RIPK3直接递送到肿瘤细胞中,那么即使无法产生坏死性凋亡通路中的这种酶或其他组分的癌细胞仍然将释放免疫刺激性的细胞因子和趋化因子。他们对一种病毒进行基因改造,使得它表达RIPK3基因的特定形式,这样这个基因就能持续保持活性状态。一旦注射到黑色素瘤中,这种病毒载体具有与早期实验中观察到的相似的肿瘤控制效果。此外,当他们将这种病毒与免疫检查点阻断---一种阻止抑制免疫系统的分子起作用的免疫疗法---相结合时,这导致更持久的肿瘤清除。
Tait指出,“这是一个相当大的发现,这是因为我们一直在谈论这个领域:以不同的方式靶向坏死性凋亡,但实际上很难找到一种可以在肿瘤细胞中开展的方法。”这些作者“非常好地”表明这种病毒方法可能是一种诱导这些细胞中RIPK3激活的方法。“唯一的问题是,我们并不确定对RIPK3的系统性激活是否会产生任何不必要的毒副作用。”
Oberst指出这种病毒递送方法可能还需在进一步的研究中加以探索。“当然,从我们习惯的真正简单的肿瘤模型到任何直接的临床应用,还有很长的路要走。”(生物谷 Bioon.com)
参考资料:
A.G. Snyder et al. Intratumoral activation of the necroptotic pathway components RIPK1 and RIPK3 potentiates antitumor immunity. Science Immunology, 2019, doi:10.1126/sciimmunol.aaw2004.
Dying Cells Push the Mouse Immune System into Killing Tumors
近年来,生物学家已开始研究在癌细胞中激活坏死性凋亡是否会同样地诱导免疫系统攻击肿瘤。如今,在一项新的研究中,来自美国华盛顿大学和罗格斯大学的研究人员发现将经历坏死性凋亡的细胞(即坏死性凋亡细胞)注入小鼠的肿瘤中会引导杀伤性T细胞攻击恶性肿瘤并减缓其生长。此外,他们发现让肿瘤细胞表达一种诱导坏死性凋亡产生的酶足以启动肿瘤缩小过程---他们认为这种策略可能能够提高现有免疫疗法的疗效。相关研究结果发表在2019年6月21日的Science Immunology期刊上,论文标题为“Intratumoral activation of the necroptotic pathway components RIPK1 and RIPK3 potentiates antitumor immunity”。

图片来自Science Immunology, 2019, doi:10.1126/sciimmunol.aaw2004。
英国癌症研究中心比森研究所癌症细胞生物学家Stephen Tait(未参与这项新的研究)评论道,“它增加了更多的证据表明在癌症中[靶向]这种类型的细胞死亡是一件好事:它会引发抗肿瘤免疫反应。它为靶向或激活这种通路作为癌症疗法提供了强有力的理由。”
为了研究坏死性凋亡细胞对肿瘤的影响,华盛顿大学博士生Annelise Snyder和她的同事们对癌细胞进行基因改造,使得RIPK3蛋白---一种触发坏死性凋亡的酶---被激活。她将这些经过基因改造的癌细胞注射到小鼠腹侧的黑色素瘤或腺癌中。在接下来的一周内,他们观察到这些小鼠的肿瘤生长减慢---经后来发现,这一过程依赖于杀伤性T细胞的存在。重要的是,这些小鼠的存活时间显著长于接受细胞凋亡诱导性酶(apoptosis-inducing enzyme, 也译作诱导细胞凋亡的酶)受到激活的癌细胞注射的小鼠。
在第一项实验中,注射的坏死性凋亡细胞来源于与肿瘤相同的细胞系,并携带相同的细胞表面抗原。但是,令这些研究人员吃惊的是,当他们将来自健康成纤维细胞系的坏死性凋亡细胞注入肿瘤中时,他们观察到肿瘤生长发生同样的减缓。对论文通讯作者、华盛顿大学癌症免疫学家Andrew Oberst来说,这些坏死性凋亡细胞不需要携带任何肿瘤抗原就能产生这种效果,这是一个了不起的发现。
对他来说,这表明坏死性凋亡细胞不是通过展示特定的抗原来指导T细胞靶向肿瘤,而是通过分泌特定的细胞因子和趋化因子来激活位于肿瘤周围的局部T细胞,并且这些T细胞已作好准备攻击这些癌细胞,但需要外部推动才能变得活跃。Oberst 表示,“位置就是一切。通过引入坏死性凋亡细胞让肿瘤微环境发生这种变化. . .是真正能让它发挥作用的原因。”
Oberst实验室之前的研究(Science, 2015, doi:10.1126/science.aad0395)已表明酶RIPK3可以驱动细胞在细胞死亡过程中产生炎性趋化因子和细胞因子,从而激活杀伤性T细胞。
进一步的实验似乎支持细胞因子和趋化因子在激活免疫系统中的重要性。比如,当这些研究人员处理坏死性凋亡细胞以减少这些细胞因子的产生,然后将它们注射到肿瘤中时,他们没有观察到他们在早期实验中观察到的生长减缓。这是令人吃惊的,这是因为人们长期以来认为坏死性凋亡本身会激发免疫系统。然而,“实际上并不是细胞死亡本身,而是细胞的破裂,才是关键事件”,他补充道,“如果我们只是诱导细胞裂解,我们看不到同样的效果。”
比利时根特癌症研究所癌症生物学家Dmitri Krysko(未参与这项新的研究)在电子邮件中表示,“这是一项非常出色和优雅的研究。”他说,那些坏死性凋亡癌细胞产生的免疫反应已经为人所知---正如他的实验室和其他人所表明的那样,但所涉及的机制在很大程度上尚未被人探究。
他写道,相比于诱导细胞凋亡,触发坏死性凋亡被认为是一种更有吸引力的策略,这些因为许多肿瘤会产生阻断或逃避细胞凋亡的方法。然而,“需要强调的是,许多癌症往往也会对坏死性凋亡产生抵抗力。”比如,已知几种癌细胞系和癌症(比如乳腺癌和急性髓性白血病)会失去RIPK3的表达,他补充道。
在进一步的实验中,Oberst和他的团队探索了一种解决这个问题的方法:如果他们能够将酶RIPK3直接递送到肿瘤细胞中,那么即使无法产生坏死性凋亡通路中的这种酶或其他组分的癌细胞仍然将释放免疫刺激性的细胞因子和趋化因子。他们对一种病毒进行基因改造,使得它表达RIPK3基因的特定形式,这样这个基因就能持续保持活性状态。一旦注射到黑色素瘤中,这种病毒载体具有与早期实验中观察到的相似的肿瘤控制效果。此外,当他们将这种病毒与免疫检查点阻断---一种阻止抑制免疫系统的分子起作用的免疫疗法---相结合时,这导致更持久的肿瘤清除。
Tait指出,“这是一个相当大的发现,这是因为我们一直在谈论这个领域:以不同的方式靶向坏死性凋亡,但实际上很难找到一种可以在肿瘤细胞中开展的方法。”这些作者“非常好地”表明这种病毒方法可能是一种诱导这些细胞中RIPK3激活的方法。“唯一的问题是,我们并不确定对RIPK3的系统性激活是否会产生任何不必要的毒副作用。”
Oberst指出这种病毒递送方法可能还需在进一步的研究中加以探索。“当然,从我们习惯的真正简单的肿瘤模型到任何直接的临床应用,还有很长的路要走。”(生物谷 Bioon.com)
参考资料:
A.G. Snyder et al. Intratumoral activation of the necroptotic pathway components RIPK1 and RIPK3 potentiates antitumor immunity. Science Immunology, 2019, doi:10.1126/sciimmunol.aaw2004.
Dying Cells Push the Mouse Immune System into Killing Tumors
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


