全文编译!我国科学发表Nature论文,揭示与COVID-19患者临床结果相关的病毒和宿主因素
来源:本站原创 2020-05-24 18:36
2020年5月24日讯/生物谷BIOON/---武汉市出现的COVID-19疫情与武汉华南海鲜批发市场(HSWM)有着密切的关系。导致这种疫情的病原体SARS-CoV-2与蝙蝠冠状病毒RaTG13密切相关,但是它的受体结合结构域与穿山甲冠状病毒更为相似。目前,关于SARS-CoV-2的起源、演化及其与宿主之间的相互作用仍有几个问题。首先,尽管HSWM市场被广
2020年5月24日讯/生物谷BIOON/---武汉市出现的COVID-19疫情与武汉华南海鲜批发市场(HSWM)有着密切的关系。导致这种疫情的病原体SARS-CoV-2与蝙蝠冠状病毒RaTG13密切相关,但是它的受体结合结构域与穿山甲冠状病毒更为相似。
目前,关于SARS-CoV-2的起源、进化及其与宿主之间的相互作用仍存在几个问题。首先,尽管HSWM市场被广泛认为是SARS-CoV-2的原始疫情爆发地点,但是在最初的一系列病例中,相当多的病例并没有接触这个市场。这使得人们对最初的疫情爆发时,人畜共患病溢出到人类中的单一事件产生了怀疑。第二,SARS-CoV-2的毒力是否由于疾病传播过程中的基因组序列进化而发生了改变,还有待更多的数据来回答。第三,虽然SARS-CoV-2感染可引起危及生命的呼吸系统疾病,但大多数病例表现为轻度肺炎。迄今为止,与疾病临床结果相关的因素尚未充分描述。
在一项新的研究中,来自中国复旦大学、上海交通大学医学院和中国科学院上海生命科学研究院的研究人员系统地分析了贯穿整个感染过程中的关键免疫学参数,直接从临床样本中获得病毒基因组,并确定了与疾病临床结果和流行病学特征相关的因素。相关研究结果于2020年5月20日在线发表在Nature期刊上,论文标题为“Viral and host factors related to the clinical outcome of COVID-19”。
患者招募概况
从1月20日至2月25日在上海共招募了326例患者。这些感染病例分为四类。5人无症状,即无明显发热、呼吸道症状和放射学表现。大部分患者(293例)病情较轻,有发热和肺炎的放射学表现。有12例患者在24~48小时内出现呼吸困难和肺部磨玻璃样阴影扩张的症状,因此被定义为重症。另有16例患者病情恶化为急性呼吸窘迫综合征(ARDS),需要机械通气或体外膜吸氧(ECMO),因此被划为危重症。截至4月1日,315例(96.63%)患者已出院;6例(1.84%)死亡。
病毒基因组中的核苷酸变异
对112个样本(痰液、口咽拭子)的测序数据进行了质量控制,并用于核苷酸变异calling(nucleotide variation calling)。与首次发布的SARS-CoV-2基因组(Wuhan-Hu-1)相比,在9个蛋白编码区总共鉴定出66个同义变异和103个非同义变异。ORF1ab、S、ORF3a、E、M和ORF7a的替换率相似(约为3.5×10-4/位点/年),而ORF8(9.51×10-4/位点/年)和N(1.05×10-3/位点/年)的变异率较高。这些上海样本与GISAID数据集之间的病毒基因组变异重复发生率相似。
基因组系统发育分析
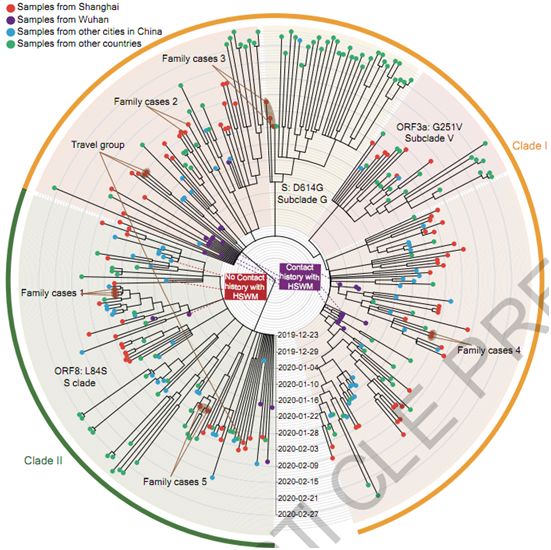
接下来,这些作者使用94个病例的病毒基因组(>90%的完整)与GISAID数据库中的221个SARS-CoV-2序列一起进行系统发育分析。两个主要支系(clade)被确定(图1),这两个支系都包括2019年12月初诊断的病例。支系I包括几个亚支系,比如通过ORF3a: p.251G>V描述的亚支系V,或者通过S:p.614D>G描述的亚支系G。支系II与支系I的区别在于两个相连的变异:ORF8: p.84L>S(28144T>C)和ORF1ab: p.2839S(8782C>T)(图1)。这些患者的序列贯穿了这两个主要支系及其亚支系,这提示着传播到上海的源头有多个。没有在上海观察到明显的支系/亚支系扩张。
此外,6例有明确的HSWM市场(疑似最初的疫情爆发地点)接触史,均被归入支系I,而同期诊断的3例无HSWM市场接触史的病例均被归入支系II(图1)。在HSWM/非HSWM相关样本和蝙蝠冠状病毒bat-SARS-CoV-RaTG13中,分析了SARS-CoV-2的nt8782和nt28144位点附近的序列。这些作者注意到非HSWM序列与Bat-SARS-CoV-RaTG13在这两个位点上是相同的。
这些作者比较了感染了支系I或支系II病毒的患者的临床表现。他们发现在疾病严重程度(p=0.88)、淋巴细胞计数(p=0.79)、CD3+ T细胞计数(p=0.21)、C反应蛋白(p=0.83)或D-二聚体(p=0.19)和发病后病毒脱落时间(p=0.79)方面没有统计学差异。因此,这两个支系的病毒表现出类似的致病效应,尽管它们的基因组序列有差异。同样地,在疾病严重程度和13种最常见的变异(同义变异和非同义变异)之间没有发现显著的关联性。
与疾病严重程度相关的宿主因素
这些患者的一个显著特点是,一些感染者(5例,1.53%)虽然可以检测到明显的病毒脱落,但没有出现明显的症状。无症状患者入院至5天后均未发现肺部有明显病变。相比之下,在轻度病例和重症病例中观察到肺部单侧和双侧磨玻璃病变,而且重症病例的病情在仅两天内就迅速恶化。
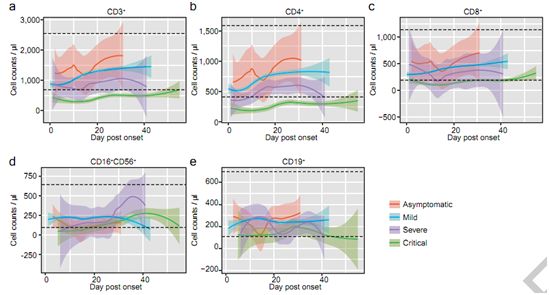
这些作者进一步分析了这些患者的免疫学和生化指标。COVID-19的一个突出特点是进行性淋巴细胞减少,尤其是重症和危重症患者(入院后的初始检测结果,P=6×10-6)。对淋巴细胞亚型的详细分析发现,CD3+ T细胞受到最显著的影响(P<10-6),CD4+ T细胞和CD8+ T细胞的趋势相似(CD4+ T细胞,P<10-6;CD8+ T细胞,P=1×10-5)。值得注意的是,T细胞的这些变化不仅在危重病例中具有统计学意义,而且在其他三类病例(无症状、轻度和重度)中也有统计学意义(CD3+ T细胞,p=0.013;CD8+ T细胞,p=0.004)。相比之下,对于CD19+ B细胞而言,虽然在危重病例中发现CD19+ B细胞显著下降(p=1×10-5),但在无症状、轻度和重度病例中未见明显变化(p=0.47)。他们进一步研究了每组病例的纵向细胞计数数据。很明显,随着病情的恶化,CD3+ T细胞呈梯度性下降(发病后第7、8、11、14~18、22~25、28、29天,克鲁斯卡尔-沃利斯检验,P<0.05),CD4+ T细胞和CD8+ T细胞也有下降的趋势(图2b-c)。然而,在自然杀伤细胞(CD16+、CD56+)或B细胞(CD19+)中没有发现这种趋势(图2d-e)。
这些作者接下来比较了按合并症(co-morbidity)分组的临床参数,发现如果将合并症考虑在内,那么疾病进展风险显著升高(p=0.01),尽管合并症组的中位年龄也较高(p=0.02)。确实,单因素逻辑回归分析表明,年龄(p<0.0001)、入院时的淋巴细胞数(p<0.0001)、合并症(p=0.01)和性别(p=0.014)是与疾病严重程度相关的主要因素。多因素分析显示,年龄(p=0.002)和淋巴细胞减少(p=0.002)是两个主要的独立因素,而合并症没有达到统计学意义。
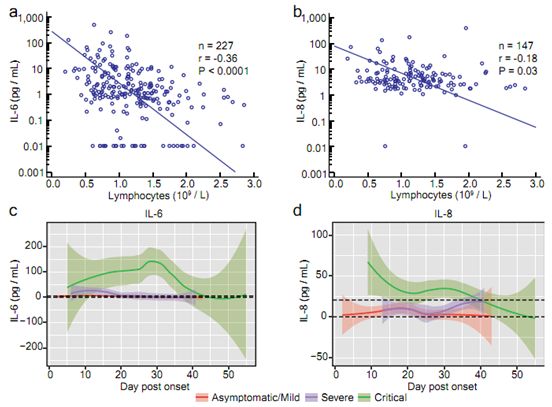
在入院时和治疗过程中测定了11种细胞因子(IFN-α、IFN-γ、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12和IL-17)在血清中的水平。其中,IL-6(p<10-6)和IL-8(p=1×10-5)显示出最显著的变化。值得注意的是,这两种细胞因子与淋巴细胞计数呈反比关系(图3a-b)。此外,这些作者结合每组病例的纵向细胞因子数据,绘制出它们随发病后时间点的波动模式。他们汇总了每个患者在发病后第6天至第10天的最高IL-6数据,并将危重患者与非危重患者进行比较。结果发现,危重患者组的IL-6水平显著高于非危重患者组(p=0.001,双侧Mann-Whitney U检验,图3c)。当汇总发病后第16天至第20天的数据时,观察到IL-8水平也有类似的显著差异(p=0.006,图3d)。这些数据表明,炎症细胞因子与SARS-CoV-2感染的发病机制之间存在密切的联系。
讨论
这些作者对一些最近治疗的患者的分析提供了进一步的证据表明SARS-CoV-2病毒基因组基本稳定。与最近的一项研究相一致的是,这些作者发现观察到的较小序列变异将这种病毒基因组分为两个主要支系。他们注意到,从有HSWM接触史的患者中获得的6个序列都属于支系I,而来自同期诊断出的患者的3个基因组被归入支系II。因此,这两个主要的单体型(haplotype)很可能代表了源自共同祖先的两个于2019年12月初在武汉市独立进化的病毒谱系,其中的一个谱系(支系I)在HSWM市场内产生,这个市场内的高密度摊贩、商贩和顾客可能促进了人与人之间的传播。与这个观点相一致的是,对12月18日之前武汉市最早的病例进行流行病学调查,发现有2名患者与HSWM市场有联系,但有5名患者与HSWM市场没有联系。这些作者的时间分辨系统发育分析表明,最早的人畜共患病溢出事件可能发生在2019年11月下旬,这与Andersen等人的分析相一致。
尽管如此,感染了支系I或支系II型病毒的患者在一系列临床特征、突变率或传播性方面没有表现出显著差异。这些数据与其他人提出的缺乏对任何一个支系的选择性是一致的,但与Tang等人的结论---他们的L/S类型分类是基于相同的两个相连的多态性---不一致。由于GISAID数据库中早期上传的序列是在有限的危重病人中获得的,而且来自同一患者的重复装配并不少见,因此推测的传播性差异可能是由于采样偏差造成的。
最近,Guan等人分析了中国1099例COVID-19患者,发现淋巴细胞减少是实验室测试中最常见的特征之一。在这项新的研究中,这些作者证实了这一观察结果,并进一步发现,CD3+ T细胞是受感染患者中受抑制的主要细胞类型,而CD19+ B细胞和CD16+CD56+自然杀伤细胞表现出较少的抑制。事实上,淋巴细胞减少,特别是CD4/CD8细胞计数减少也是SARS-CoV-2感染的主要表现。
此外,这些作者对主要细胞因子的纵向监测表明,IL-6和IL-8与淋巴细胞计数呈负相关,IL-6动力学与疾病严重程度高度相关。目前,病毒活性、细胞因子释放和淋巴细胞减少之间的关系仍不清楚。他们推测,对SARS-CoV-2的免疫病理反应包括“细胞因子风暴”和CD3+ T淋巴细胞减少,至少在一定程度上可以构成疾病进展和死亡的基本机制。正如在受感染患者和猕猴身上观察到的那样,肺部巨噬细胞可能作为COVID-19肺炎早期阶段的“细胞因子风暴”的第一驱动力,随后细胞因子动员的淋巴细胞浸润可能解释了淋巴细胞减少,尽管不能排除可能的细胞因子诱导的T细胞衰竭。
总之,通过密切监测326例COVID-19患者的分子和免疫学数据,这些作者提出不良的临床结果与CD3+ T淋巴细胞衰竭有关,这种衰竭与IL-6和IL-8等细胞因子的急剧增加密切相关。针对1月下旬至2月期间感染的94例病例的靶向测序结果发现这种病毒基因组中的有限变异提示着稳定的进化。来自同一祖先的两个主要病毒谱系可能于2019年12月在武汉独立进化,尽管在临床表现或传播性方面没有发现它们之间存在重大差异。这些数据为揭示病毒和宿主因素在疾病机制中各自发挥的作用提供了进一步的证据,并强调了早期干预治疗的重要性。(生物谷 Bioon.com)
参考资料:
Xiaonan Zhang et al. Viral and host factors related to the clinical outcome of COVID-19. Nature, 2020, doi:10.1038/s41586-020-2355-0.
目前,关于SARS-CoV-2的起源、进化及其与宿主之间的相互作用仍存在几个问题。首先,尽管HSWM市场被广泛认为是SARS-CoV-2的原始疫情爆发地点,但是在最初的一系列病例中,相当多的病例并没有接触这个市场。这使得人们对最初的疫情爆发时,人畜共患病溢出到人类中的单一事件产生了怀疑。第二,SARS-CoV-2的毒力是否由于疾病传播过程中的基因组序列进化而发生了改变,还有待更多的数据来回答。第三,虽然SARS-CoV-2感染可引起危及生命的呼吸系统疾病,但大多数病例表现为轻度肺炎。迄今为止,与疾病临床结果相关的因素尚未充分描述。

图1.对组装的SARS-CoV-2基因组的系统发育分析。
在一项新的研究中,来自中国复旦大学、上海交通大学医学院和中国科学院上海生命科学研究院的研究人员系统地分析了贯穿整个感染过程中的关键免疫学参数,直接从临床样本中获得病毒基因组,并确定了与疾病临床结果和流行病学特征相关的因素。相关研究结果于2020年5月20日在线发表在Nature期刊上,论文标题为“Viral and host factors related to the clinical outcome of COVID-19”。
患者招募概况
从1月20日至2月25日在上海共招募了326例患者。这些感染病例分为四类。5人无症状,即无明显发热、呼吸道症状和放射学表现。大部分患者(293例)病情较轻,有发热和肺炎的放射学表现。有12例患者在24~48小时内出现呼吸困难和肺部磨玻璃样阴影扩张的症状,因此被定义为重症。另有16例患者病情恶化为急性呼吸窘迫综合征(ARDS),需要机械通气或体外膜吸氧(ECMO),因此被划为危重症。截至4月1日,315例(96.63%)患者已出院;6例(1.84%)死亡。
病毒基因组中的核苷酸变异
对112个样本(痰液、口咽拭子)的测序数据进行了质量控制,并用于核苷酸变异calling(nucleotide variation calling)。与首次发布的SARS-CoV-2基因组(Wuhan-Hu-1)相比,在9个蛋白编码区总共鉴定出66个同义变异和103个非同义变异。ORF1ab、S、ORF3a、E、M和ORF7a的替换率相似(约为3.5×10-4/位点/年),而ORF8(9.51×10-4/位点/年)和N(1.05×10-3/位点/年)的变异率较高。这些上海样本与GISAID数据集之间的病毒基因组变异重复发生率相似。
基因组系统发育分析
接下来,这些作者使用94个病例的病毒基因组(>90%的完整)与GISAID数据库中的221个SARS-CoV-2序列一起进行系统发育分析。两个主要支系(clade)被确定(图1),这两个支系都包括2019年12月初诊断的病例。支系I包括几个亚支系,比如通过ORF3a: p.251G>V描述的亚支系V,或者通过S:p.614D>G描述的亚支系G。支系II与支系I的区别在于两个相连的变异:ORF8: p.84L>S(28144T>C)和ORF1ab: p.2839S(8782C>T)(图1)。这些患者的序列贯穿了这两个主要支系及其亚支系,这提示着传播到上海的源头有多个。没有在上海观察到明显的支系/亚支系扩张。
此外,6例有明确的HSWM市场(疑似最初的疫情爆发地点)接触史,均被归入支系I,而同期诊断的3例无HSWM市场接触史的病例均被归入支系II(图1)。在HSWM/非HSWM相关样本和蝙蝠冠状病毒bat-SARS-CoV-RaTG13中,分析了SARS-CoV-2的nt8782和nt28144位点附近的序列。这些作者注意到非HSWM序列与Bat-SARS-CoV-RaTG13在这两个位点上是相同的。
这些作者比较了感染了支系I或支系II病毒的患者的临床表现。他们发现在疾病严重程度(p=0.88)、淋巴细胞计数(p=0.79)、CD3+ T细胞计数(p=0.21)、C反应蛋白(p=0.83)或D-二聚体(p=0.19)和发病后病毒脱落时间(p=0.79)方面没有统计学差异。因此,这两个支系的病毒表现出类似的致病效应,尽管它们的基因组序列有差异。同样地,在疾病严重程度和13种最常见的变异(同义变异和非同义变异)之间没有发现显著的关联性。
与疾病严重程度相关的宿主因素
这些患者的一个显著特点是,一些感染者(5例,1.53%)虽然可以检测到明显的病毒脱落,但没有出现明显的症状。无症状患者入院至5天后均未发现肺部有明显病变。相比之下,在轻度病例和重症病例中观察到肺部单侧和双侧磨玻璃病变,而且重症病例的病情在仅两天内就迅速恶化。

图2.每组患者住院期间CD3+ (a)、CD4+ (b)、CD8+ (c)、CD16+CD56+ (d)、CD19+ (e)细胞计数的时间变化。
这些作者进一步分析了这些患者的免疫学和生化指标。COVID-19的一个突出特点是进行性淋巴细胞减少,尤其是重症和危重症患者(入院后的初始检测结果,P=6×10-6)。对淋巴细胞亚型的详细分析发现,CD3+ T细胞受到最显著的影响(P<10-6),CD4+ T细胞和CD8+ T细胞的趋势相似(CD4+ T细胞,P<10-6;CD8+ T细胞,P=1×10-5)。值得注意的是,T细胞的这些变化不仅在危重病例中具有统计学意义,而且在其他三类病例(无症状、轻度和重度)中也有统计学意义(CD3+ T细胞,p=0.013;CD8+ T细胞,p=0.004)。相比之下,对于CD19+ B细胞而言,虽然在危重病例中发现CD19+ B细胞显著下降(p=1×10-5),但在无症状、轻度和重度病例中未见明显变化(p=0.47)。他们进一步研究了每组病例的纵向细胞计数数据。很明显,随着病情的恶化,CD3+ T细胞呈梯度性下降(发病后第7、8、11、14~18、22~25、28、29天,克鲁斯卡尔-沃利斯检验,P<0.05),CD4+ T细胞和CD8+ T细胞也有下降的趋势(图2b-c)。然而,在自然杀伤细胞(CD16+、CD56+)或B细胞(CD19+)中没有发现这种趋势(图2d-e)。
这些作者接下来比较了按合并症(co-morbidity)分组的临床参数,发现如果将合并症考虑在内,那么疾病进展风险显著升高(p=0.01),尽管合并症组的中位年龄也较高(p=0.02)。确实,单因素逻辑回归分析表明,年龄(p<0.0001)、入院时的淋巴细胞数(p<0.0001)、合并症(p=0.01)和性别(p=0.014)是与疾病严重程度相关的主要因素。多因素分析显示,年龄(p=0.002)和淋巴细胞减少(p=0.002)是两个主要的独立因素,而合并症没有达到统计学意义。

图3.炎症细胞因子与淋巴细胞计数的相关性。
在入院时和治疗过程中测定了11种细胞因子(IFN-α、IFN-γ、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12和IL-17)在血清中的水平。其中,IL-6(p<10-6)和IL-8(p=1×10-5)显示出最显著的变化。值得注意的是,这两种细胞因子与淋巴细胞计数呈反比关系(图3a-b)。此外,这些作者结合每组病例的纵向细胞因子数据,绘制出它们随发病后时间点的波动模式。他们汇总了每个患者在发病后第6天至第10天的最高IL-6数据,并将危重患者与非危重患者进行比较。结果发现,危重患者组的IL-6水平显著高于非危重患者组(p=0.001,双侧Mann-Whitney U检验,图3c)。当汇总发病后第16天至第20天的数据时,观察到IL-8水平也有类似的显著差异(p=0.006,图3d)。这些数据表明,炎症细胞因子与SARS-CoV-2感染的发病机制之间存在密切的联系。
讨论
这些作者对一些最近治疗的患者的分析提供了进一步的证据表明SARS-CoV-2病毒基因组基本稳定。与最近的一项研究相一致的是,这些作者发现观察到的较小序列变异将这种病毒基因组分为两个主要支系。他们注意到,从有HSWM接触史的患者中获得的6个序列都属于支系I,而来自同期诊断出的患者的3个基因组被归入支系II。因此,这两个主要的单体型(haplotype)很可能代表了源自共同祖先的两个于2019年12月初在武汉市独立进化的病毒谱系,其中的一个谱系(支系I)在HSWM市场内产生,这个市场内的高密度摊贩、商贩和顾客可能促进了人与人之间的传播。与这个观点相一致的是,对12月18日之前武汉市最早的病例进行流行病学调查,发现有2名患者与HSWM市场有联系,但有5名患者与HSWM市场没有联系。这些作者的时间分辨系统发育分析表明,最早的人畜共患病溢出事件可能发生在2019年11月下旬,这与Andersen等人的分析相一致。
尽管如此,感染了支系I或支系II型病毒的患者在一系列临床特征、突变率或传播性方面没有表现出显著差异。这些数据与其他人提出的缺乏对任何一个支系的选择性是一致的,但与Tang等人的结论---他们的L/S类型分类是基于相同的两个相连的多态性---不一致。由于GISAID数据库中早期上传的序列是在有限的危重病人中获得的,而且来自同一患者的重复装配并不少见,因此推测的传播性差异可能是由于采样偏差造成的。
最近,Guan等人分析了中国1099例COVID-19患者,发现淋巴细胞减少是实验室测试中最常见的特征之一。在这项新的研究中,这些作者证实了这一观察结果,并进一步发现,CD3+ T细胞是受感染患者中受抑制的主要细胞类型,而CD19+ B细胞和CD16+CD56+自然杀伤细胞表现出较少的抑制。事实上,淋巴细胞减少,特别是CD4/CD8细胞计数减少也是SARS-CoV-2感染的主要表现。
此外,这些作者对主要细胞因子的纵向监测表明,IL-6和IL-8与淋巴细胞计数呈负相关,IL-6动力学与疾病严重程度高度相关。目前,病毒活性、细胞因子释放和淋巴细胞减少之间的关系仍不清楚。他们推测,对SARS-CoV-2的免疫病理反应包括“细胞因子风暴”和CD3+ T淋巴细胞减少,至少在一定程度上可以构成疾病进展和死亡的基本机制。正如在受感染患者和猕猴身上观察到的那样,肺部巨噬细胞可能作为COVID-19肺炎早期阶段的“细胞因子风暴”的第一驱动力,随后细胞因子动员的淋巴细胞浸润可能解释了淋巴细胞减少,尽管不能排除可能的细胞因子诱导的T细胞衰竭。
总之,通过密切监测326例COVID-19患者的分子和免疫学数据,这些作者提出不良的临床结果与CD3+ T淋巴细胞衰竭有关,这种衰竭与IL-6和IL-8等细胞因子的急剧增加密切相关。针对1月下旬至2月期间感染的94例病例的靶向测序结果发现这种病毒基因组中的有限变异提示着稳定的进化。来自同一祖先的两个主要病毒谱系可能于2019年12月在武汉独立进化,尽管在临床表现或传播性方面没有发现它们之间存在重大差异。这些数据为揭示病毒和宿主因素在疾病机制中各自发挥的作用提供了进一步的证据,并强调了早期干预治疗的重要性。(生物谷 Bioon.com)
参考资料:
Xiaonan Zhang et al. Viral and host factors related to the clinical outcome of COVID-19. Nature, 2020, doi:10.1038/s41586-020-2355-0.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


