Nature:麻省理工学院揭示阿尔茨海默病中脆弱神经元与认知恢复能力之谜
来源:生物谷原创 2024-08-05 10:38
在一项新的研究中,来自麻省理工学院的研究人员为特定细胞和回路如何在阿尔茨海默病(Alzheimer's disease, AD)中变得脆弱提供了新的证据,并深入研究了可能有助于一些人即使在疾病病理迹象
在一项最新的研究中,来自麻省理工学院的研究人员为特定细胞和神经回路如何在阿尔茨海默病(AD)中变得脆弱提供了新的证据,并深入探讨了可能帮助一部分患者在疾病病理迹象明显的情况下仍能保持认知能力的因素。
相关研究结果于2024年7月24日在线发表在Nature期刊上,论文标题为“Single-cell multiregion dissection of Alzheimer’s disease”。

为了突出维持认知和记忆的潜在干预目标,研究人员比较了患有或未患有阿尔茨海默病的人的多个大脑区域中的基因表达,并进行了实验室实验来测试和验证他们的主要发现。
虽然所有脑细胞都具有相同的DNA,但它们身份和活性的不同在于它们表达这些基因的方式。这项新研究测量了来自48名组织捐赠者的六个大脑区域中70多种细胞类型的130多万个细胞的基因表达差异,其中26人死于阿尔茨海默病,22人死于非阿尔茨海默病。因此,这项研究提供了独特的、广泛而详细的数据,揭示了阿尔茨海默病患者的脑细胞活动在细胞类型、大脑区域、疾病病理及患者生前的认知评估方面的差异。
论文共同通讯作者、麻省理工学院皮考尔神经科学教授Li-Huei Tsai说:“阿尔茨海默病患者的特定大脑区域很脆弱,因此我们需要了解这些大脑区域或特定细胞类型是如何变得脆弱的。大脑不仅包含神经元,还包括许多其他类型的细胞。这些细胞如何根据不同位置做出不同的反应,是我们刚刚开始研究的一个有趣领域。”
论文共同通讯作者、麻省理工学院计算生物学组组长Manolis Kellis将用于测量基因表达比较的技术——单细胞RNA分析技术,比喻为更为先进的“显微镜”。
Kellis说:“Alzheimer在显微镜下看到的是淀粉样蛋白斑块和磷酸化tau缠结物,而我们的单细胞‘显微镜’能够逐个细胞、逐个基因地告诉我们病理变化带来的成千上万种微妙而重要的生物学变化。将这些信息与患者的认知状态联系起来,可以揭示细胞反应与认知能力丧失或保持之间的关系,有助于提出治疗认知能力丧失的新方法。”
神经脆弱性和Reelin蛋白
研究小组分析了前额叶皮层、内嗅皮层、海马体、丘脑前部、角形脑回和中颞皮层等大脑区域。
研究发现,阿尔茨海默病患者的海马体中的一种兴奋性神经元和内嗅皮层中的四种兴奋性神经元数量明显减少。这些细胞减少的患者在认知评估中的表现明显较差。许多脆弱的神经元在一个共同的神经回路中相互连接,并且直接表达一种叫做Reelin的蛋白,或者受到Reelin信号传导的影响。
这些研究结果强调了特别脆弱的神经元,它们共享一个神经回路和一条分子通路,这些神经元的缺失与认知能力下降有关。
Li-Huei Tsai教授指出,Reelin在阿尔茨海默病研究中的重要性凸显是因为最近对一名来自哥伦比亚的男子的研究。这名男子的Reelin基因发生了罕见突变,使得Reelin蛋白的活性增强。尽管他的家族有强烈的早发性阿尔茨海默病遗传倾向,但他却能在高龄时保持健康的认知能力。这项新研究进一步表明,产生Reelin的神经元丧失与认知能力下降有关。
为了进一步验证他们的研究成果,研究者直接研究了人类脑组织样本和两种阿尔茨海默病小鼠模型的大脑。正如预期的那样,这些实验结果显示,无论是人类还是小鼠,内嗅皮层中的Reelin阳性神经元数量均有所减少。
与星形胶质细胞胆碱代谢有关的恢复能力
为了找到即使在病理状态下也能保持认知能力的因素,研究人员研究了哪些基因、哪些细胞和哪些大脑区域与认知恢复能力最密切相关,定义认知恢复能力为:在观察到的病理状态下,高于预期的典型认知损失的残余认知功能。
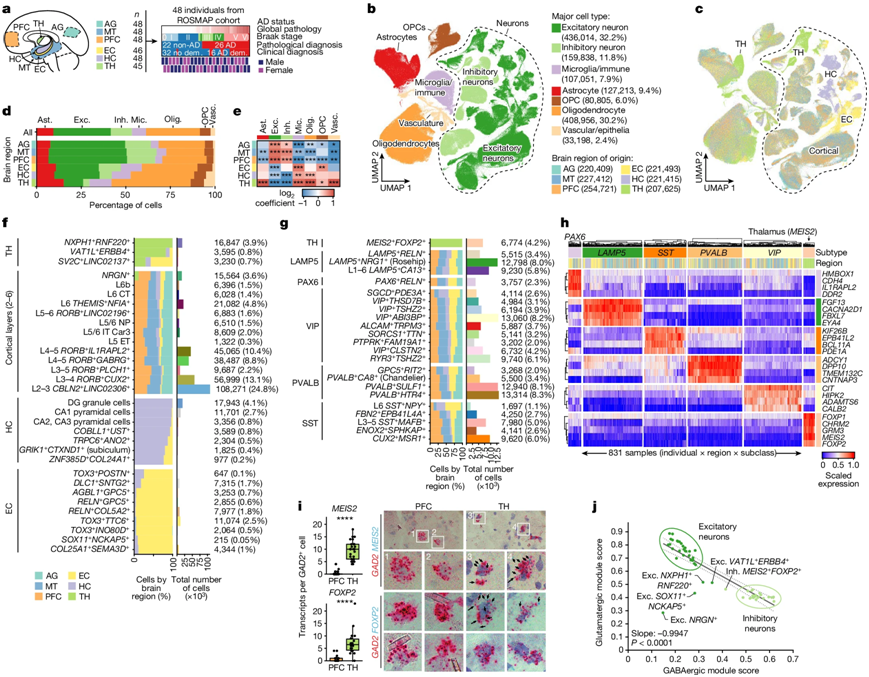
图片来自Nature, 2024, doi:10.1038/s41586-024-07606-7
他们的分析得出了一个令人惊讶的答案:在多个大脑区域,表达与抗氧化活性、胆碱代谢和多胺生物合成相关基因的星形胶质细胞与持续的认知能力显著相关,即使在高水平的tau和淀粉样蛋白的情况下也是如此。
这一研究结果进一步支持了Tsai和Susan Lundqvist先前的研究成果,即通过饮食补充胆碱可以帮助星形胶质细胞应对由阿尔茨海默病最重要的风险基因——APOE4变体,引起的脂质失调问题。
此外,抗氧化研究还发现了一种可作为膳食补充剂的分子——亚精胺(spermidine),它可能具有抗炎特性。不过,这种关联还需要进一步研究来确定其因果关系。
新的分析方法,开放的数据集
为了分析堆积如山的单细胞数据,这些研究人员开发了一种基于协同表达基因簇(称为“基因模块”)的新型稳健方法,这种方法利用了同一模块中功能相关基因之间的表达相关模式。Kellis解释说:“理论上,我们研究的130万个细胞可以利用它们的2万个基因形成天文数字般的不同组合。然而,在实践中,我们观察到的实际上是协调变化的一小部分。通过识别这些协调模式,我们能够推断出更为可靠的变化,因为这些变化是基于相同功能连接模块中的多个基因。”
他打了个比方:人的身体有很多关节,可以做出各种复杂的动作,但实际上,人体从事的协调运动要少得多,例如走路、跑步或跳舞。这种新方法使科学家们能够将这些协调的基因表达程序识别为一个基因簇。
虽然Kellis实验室和Tsai实验室已经报告了这个数据集中几项值得注意的发现,但他们预计还有更多具有重大意义的发现等待着他们去探索。为了促进这些发现,他们在Kellis的网站上发布了方便的分析和可视化工具以及他们的数据集。
展望未来,研究人员正在研究与差异表达基因相关的控制回路,以了解基因变异、调控因子和其他驱动因素。这些因素可以通过调节来逆转大脑区域中的致病回路、细胞类型和这种疾病的不同阶段。(生物谷Bioon.com)
参考资料:
Hansruedi Mathys et al. Single-cell multiregion dissection of Alzheimer's disease. Nature, 2024, doi:10.1038/s41586-024-07606-7.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


