仿生矿化铁蛋白用于实体肿瘤靶向递送研究获进展
来源:过程工程所 2021-12-22 21:57
铁蛋白(Fn)是一种具有独特空腔和孔道结构的内源性蛋白,可以作为天然的药物载体。肿瘤细胞表面通常高表达铁蛋白受体,借助该识别途径可实现药物向肿瘤细胞的靶向递送。然而,铁蛋白受体在肝脏等正常组织也会非特异性表达,影响了铁蛋白向实体肿瘤递送药物的效率。近日,中国科学院过程工程研究所生化工程国家重点实验室研究员魏炜团队提出利用仿生矿化策略使
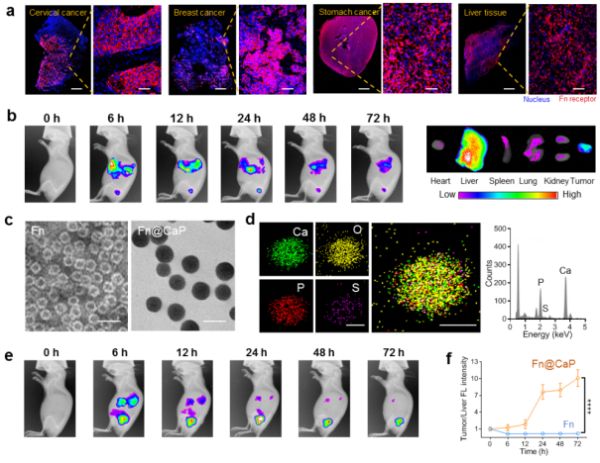
铁蛋白(Fn)是一种具有独特空腔和孔道结构的内源性蛋白,可以作为天然的药物载体。肿瘤细胞表面通常高表达铁蛋白受体,借助该识别途径可实现药物向肿瘤细胞的靶向递送。然而,铁蛋白受体在肝脏等正常组织也会非特异性表达,影响了铁蛋白向实体肿瘤递送药物的效率。近日,中国科学院过程工程研究所生化工程国家重点实验室研究员魏炜团队提出利用仿生矿化策略使铁蛋白表面生长出磷酸钙外壳,借助“隐形”作用避免了肝脏过表达铁蛋白受体产生的截留效应,提高了实体肿瘤的靶向能力。该体系还可以协同调控实体肿瘤内微环境,并可按需装载不同种类的抗肿瘤药物,在多种小鼠模型上显着提高治疗效果。相关成果发表在Advanced Materials上。
该团队首先收集临床样本,通过免疫荧光染色证实铁蛋白受体在实体肿瘤和肝脏中均有较高的表达水平,并通过实验证实这种非特异性表达会带来肝脏的截留效应,降低铁蛋白向实体肿瘤的富集。为了解决上述难题,研究团队提出了仿生矿化的新策略,在铁蛋白表面原位生长出生物安全性好的磷酸钙“隐形外壳”。以此获得的矿化铁蛋白(Fn@CaP)静脉注射后成功屏蔽了肝脏中铁蛋白受体的识别作用,显着降低了肝脏的截留效应,并增加了其向实体肿瘤的富集。
当Fn@CaP到达实体肿瘤后,还可以显着调节肿瘤微环境。首先,肿瘤细胞代谢产生的乳酸使得磷酸钙外壳溶解,这个过程会消耗氢离子,进而有效改善肿瘤酸性微环境。其次,酸性微环境的改善可以促进M2型巨噬细胞向M1型极化,从而改善肿瘤免疫抑制微环境。另外,磷酸钙外壳溶解产生的大量钙离子还可以进一步促进肿瘤的钙化。
除了上述功能,Fn@CaP载体还可以按需装载不同的抗肿瘤药物。例如,铁蛋白内腔可以基于原位成核方式高效装载化疗药物三价砷,在患者来源的异种移植瘤(PDX)模型中有效抑制肿瘤的生长。进一步,磷酸钙外壳可通过配位方式高效负载光敏剂吲哚菁绿(ICG),借助化疗和光热治疗的联合,在PDX模型中完全抑制难治型肿瘤的生长。
近五年,该研究团队提出了仿生剂型工程的新策略,基于蛋白、细菌、细胞等体内组分发现和创制了一系列仿生递送新剂型,借助固有的天然路径实现体内的精准递送,在动物模型上成功用于靶向治疗、免疫治疗和个体化治疗,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


