6月 Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2023-06-30 16:36
时光总是匆匆易逝,转眼间6月份即将结束,在即将过去的6月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时光总是匆匆易逝,转眼间6月份即将结束,在即将过去的6月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:“跳跃基因”或能改变人类结肠组织的基因组特征 从而有望揭示机体衰老和癌症发生的奥秘
doi:10.1038/s41586-023-06046-z
在人的一生中,机体基因组的改变会在体细胞中进行积累,然而,人类基因组中广泛存在的可移动元件—长散在核元件-1(L1,long interspersed nuclear element-1)的逆转录转座所诱导的突变蓝图在正常细胞中并不为研究人员所理解。近日,一篇发表在国际杂志Nature上题为“Widespread somatic L1 retrotransposition in normal colorectal epithelium”的研究报告中,来自韩国科学技术院等机构的科学家们通过研究针对人类大肠的完整基因组中的跳跃基因进行了一项突破性的研究;文章中,研究人员揭示了长散在核元件-1(L1)非常令人惊讶的活性,这种类型的跳跃基因此前被认为在人类基因组中大多处于休眠状态,然而本文研究发现,L1基因则能被激活并在一个人的一生中破坏基因组的功能,尤其是在结直肠上皮组织中。
大约有50万个L1跳跃基因占据了人类基因组中17%的比例,其通常会因在基因组序列中引入“破坏性创新”(disruptive innovation)而在人类进化过程中所作出的贡献而为科学家们所知,截至目前为止,研究人员认为,大多数的L1元件在现代人类的正常组织中失去了跳跃的能力。然而,本文研究揭示,某些L1跳跃基因能在正常细胞中被广泛激活,从而导致个体在一生时间中基因组突变的积累,L1跳跃的速率和所导致的基因组变化在不同的细胞类型中有所不同,而且其在老化的结肠上皮细胞中会存在一个显著的浓度,本文研究表明,每个结肠上皮细胞都会在个体平均40岁时经历一次L1的跳跃事件。
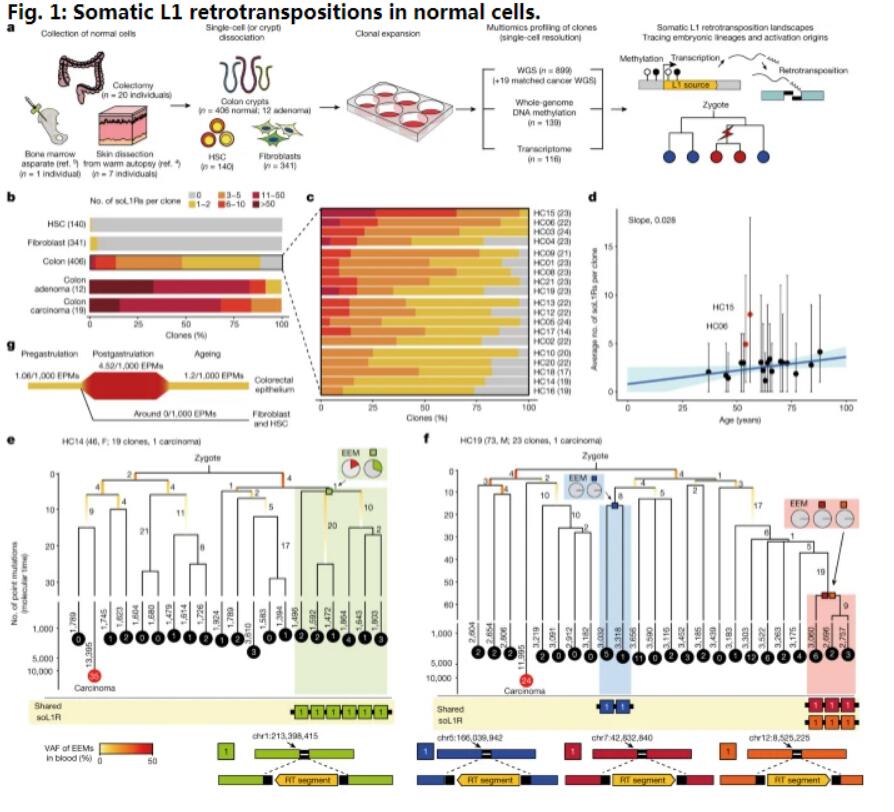
“跳跃基因”或能改变人类结肠组织的基因组特征 从而有望揭示机体衰老和癌症发生的奥秘。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06046-z
文章中,研究人员对来自29名个体机体皮肤(成纤维细胞)、血液和结肠上皮组织中共899个单一细胞进行全基因组序列分析,结果发现了正常细胞中或许存在L1跳跃基因的激活,从而就会导致机体随着时间延续出现基因组突变的逐渐积累。此外,研究人员还深入探索了表观基因组(DNA甲基化)序列来理解L1跳跃基因激活背后的分子机制,他们发现,携带活性L1跳跃基因的细胞能表现出表观遗传的不稳定性,这也就表明了表观遗传学改变在调节L1跳跃基因活性上的关键角色;大多数的表观基因组不稳定性会出现在胚胎发育的早期阶段,相关研究结果货位人类结肠组织的老化过程和疾病的发展提供了非常宝贵的见解。
【2】Nature:克服癌症研究中的艰巨挑战!给小分子化合物添加鱼钩成功靶向癌症靶标MYC、c-JUN和MIR155
doi:10.1038/s41586-023-06091-8
癌基因MYC被称为癌症研究的“珠穆朗玛峰”,因为设计能使它失效的药物非常困难,而且人们期望一种有效的MYC药物能帮助如此多的癌症患者。近日,一篇发表在国际杂志Nature上题为“Programming inactive RNA-binding small molecules into bioactive degraders”的研究报告中,来自美国和德国的研究人员成功地开发出了让MYC失效的候选药物,同时也为治疗其他类似的难以治疗的疾病开辟了新途径。
他们的方法是将细胞的回收酶(recycling enzyme)引向癌基因转录后产生的RNA,并切断它们的关键部分以防止它们造成伤害。这种降解RNA的策略对癌基因MYC起作用,同时也对另外两个具有挑战性的癌基因---JUN和MIR155---起作用。所有这三个癌基因都调节其他基因的转录,从而促进了肿瘤的快速生长。研究者Herbert Waldmann博士说,“对于那些疾病由这些常见但具有挑战性的癌基因驱动的癌症患者,这种RNA降解方法可能提供了新的希望。”
相关研究结果也为利用药物靶向RNA开辟了新的可能性,为这种治疗方法治疗潜在的许多其他遗传疾病打开了大门。Disney说,“我们发现了大约2000种能够利用药物类小分子结合的新型RNA结构,并确定了六种新的能够结合RNA的化学型(chemotype)。我们基本上创建了一个可利用药物进行靶向的RNA折叠结构的百科全书。”MYC是最具挑战性的药物靶标之一。它的激活可能影响70%或以上的人类癌症。它可以指导许多其他基因的转录或沉默。它影响细胞生长,甚至影响导致受损细胞自我毁灭的细胞自杀程序,这一重要过程被称为细胞凋亡。它还影响到受损DNA的修复过程,以及血管的生长。在许多癌症中,MYC过度表达,导致细胞生长和分裂过快。
【3】Nature:挑战常规!人类大脑的形状竟能影响它的工作方式
doi:10.1038/s41586-023-06098-1
一个多世纪以来,科学家们一直认为确定我们的经验、希望和梦想的大脑活动模式是由不同的大脑区域如何通过由数万亿个脑细胞连接组成的复杂网络相互沟通决定的。如今,一篇发表在国际杂志Nature上题为“Geometric constraints on human brain function”的研究报告中,来自澳大利亚莫纳什大学等研究机构的研究人员将物理学、神经科学和心理学的方法结合在一起,探究了1万多幅不同的人类大脑活动图,发现人类大脑的整体形状对我们的思考、感觉和行为的影响远远大于它的复杂神经元连接。这一发现推翻了这种一百多年强调复杂的大脑连接性重要性的观点,并确定了大脑形状和活动之间以前未被重视的关系。
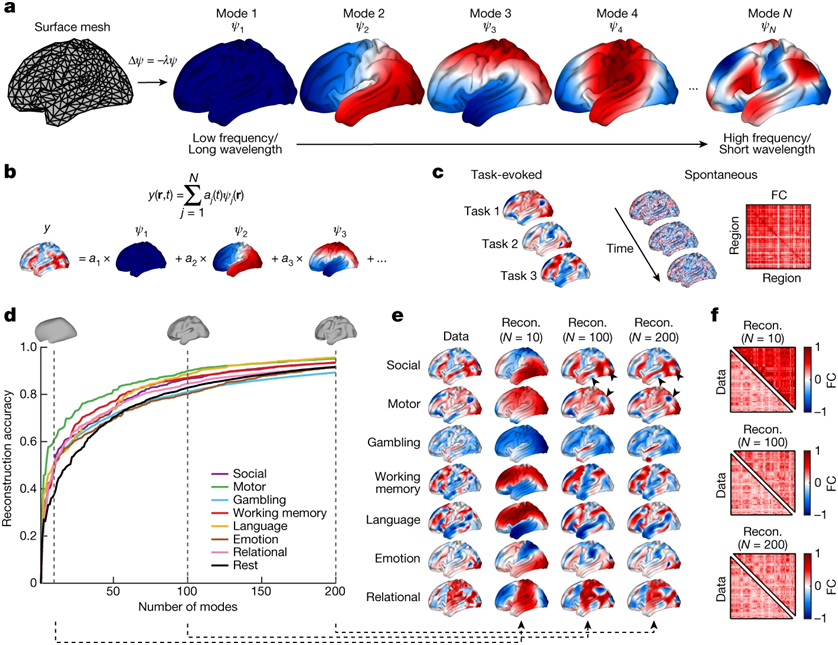
基于几何本征模式的新皮层活动重建。
图片来源:Nature, 2023, doi:10.1038/s41586-023-06098-1。
研究者James Pang博士说,这些发现意义重大,因为它们大大简化了我们研究大脑功能、发育和衰老的方式。Pang博士说,“通过考虑基于大脑形状的模型,这项新的研究为理解痴呆症和中风等疾病的影响提供了机会,毕竟这些模型比基于大脑全部神经连接的模型要容易处理得多。”他说,“我们长期以来一直认为特定的想法或感觉会引起大脑特定部位的活动,但这项新的研究显示,结构化的活动模式几乎在整个大脑中被激发,就像一个音符产生于沿着小提琴弦的整个长度发生的振动,而不仅仅是一个孤立的弦段。”
这些作者使用磁共振成像(MRI)来研究本征模式(eigenmodes),这是一个系统中振动或激励的自然模式,在这种系统中,它的不同部分都以相同的频率被激励。本征模式通常用于研究物理学和工程学等领域的物理系统,最近才被用于研究大脑。
【4】Nature:揭示染色体不稳定性和表观遗传改变之间存在意想不到的关联性
doi:10.1038/s41586-023-06084-7
近日,一篇发表在国际杂志Nature上题为“Epigenetic dysregulation from chromosomal transit in micronuclei”的研究报告中,来自美国纪念斯隆凯特琳癌症中心的研究人员通过研究揭示了癌症的两种重要特征---染色体不稳定性和表观遗传学改变---之间的一个先前未知的联系。这一发现不仅为基础科学生物学研究开辟了一个肥沃的新领域,而且对临床治疗也有影响。
染色体不稳定性与每个癌细胞携带的染色体数量的变化有关。表观遗传学改变影响了细胞中哪些基因开启或关闭,但没有修改它们的DNA代码。染色体是紧密包装的DNA链,携带我们的遗传信息。正常情况下,我们每个细胞有46条染色体--一半来自父亲,一半来自母亲。当一个细胞通过分裂产生它的子细胞时,所有这些染色体都应该传递到到新的子细胞中,但在癌症中,这个过程可能会出现可怕的错误。
研究者Samuel Bakhoum博士说,“我的实验室试图回答的一个大问题是,染色体不稳定如何驱动癌症进化、进展、转移和耐药性。这是癌症的一种特征,尤其是晚期癌症,这会使得正常的细胞分裂过程会出现混乱。你可能有一个含有69条染色体而不是46条染色体的细胞,紧挨着一个含有80条染色体的细胞。”这个领域的主流观点是,癌细胞在分裂时通过重组它们的遗传物质来增加它们生存的机会。这个过程增加了一些随机变化的几率,使得新产生的子细胞能够抵御免疫系统攻击和医疗干预措施。Bakhoum说,“然而,这项新的研究表明,这只是故事的一部分。”这是因为你可以有两个癌细胞,每个都有相同数量的特定染色体的额外拷贝,但每个都有不同的基因开启或关闭。这是由于额外的表观遗传学变化。
【5】Nature:揭示紫外线辐射在一种罕见的皮肤白血病产生中起作用
doi:10.1038/s41586-023-06156-8
近日,一篇发表在国际杂志Nature上题为“Ultraviolet radiation shapes dendritic cell leukaemia transformation in the skin”的研究报告中,来自美国丹娜-法伯癌症研究所、布莱根妇女医院和布罗德研究所的研究人员发现一些癌前细胞从骨髓迁移到皮肤中经历阳光照射的地方可能触发它们出现基因变化,这是癌症的前兆。尽管这项研究着重关注一种罕见的癌症形式---母细胞性浆细胞样树突细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm, BPDCN),但是它可能揭示了其他癌症是如何产生的,特别是那些涉及通过血液流向身体各个角落的血细胞或淋巴细胞的癌症。
研究者的Andrew Lane博士说,“我们体内的细胞生活在非常不同的环境中,这取决于它们所在的器官或组织。在这项研究中,我们展示了暴露在这些环境中的不止一种环境中,如何塑造癌前细胞向肿瘤细胞的演变。”他继续说,“这些结果增加了我们对BPDCN产生的理解,这对设计新的和更好的疾病治疗方法至关重要。它们也可能适用于任何在一个以上部位进化的癌症---并有可能适用于癌症转移到身体其他部位后的变化。”
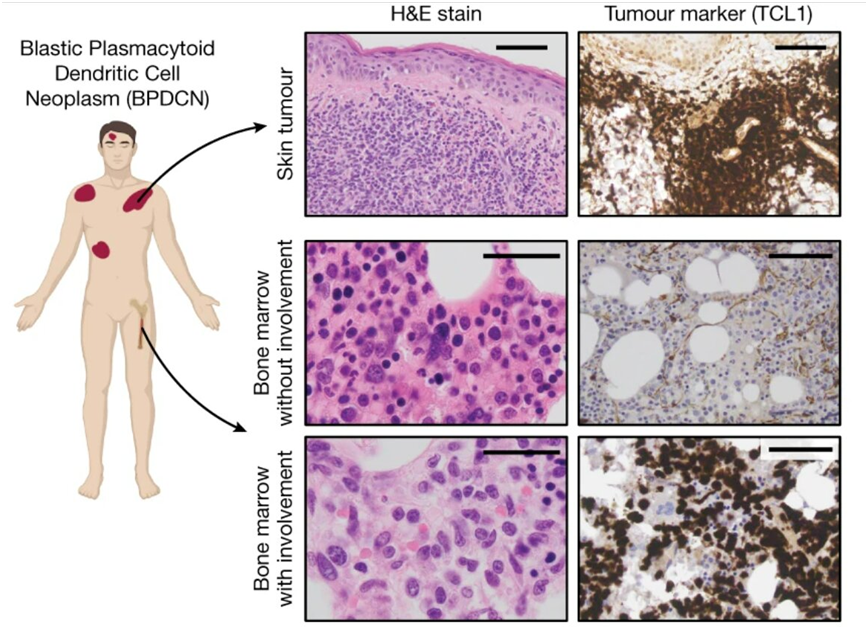
图片来源:Nature, 2023, doi:10.1038/s41586-023-06156-8。
BPDCN是一种侵袭性的骨髓和血液恶性肿瘤,在美国每年有200~400人被诊断出,通常发生在60岁或以上的患者身上,男性比女性更常见。它也是白血病中的一种异常现象。Lane说,“在患者首次就医时,大约有一半人的皮肤上有白血病细胞肿瘤,但当我们检查他们的骨髓、血液或淋巴结--我们期望在那里找到白血病细胞--我们没有看到任何异常情况。另外一半人在更传统的地方有皮肤肿瘤以及白血病细胞。”第一组患者的症状令人费解,因为根据白血病的进展模式,癌细胞首先出现在骨髓中,然后通过血液到达身体的其他部位,包括皮肤。这些患者有皮肤病变,但显然骨髓是正常的,这一事实违背了这种进展模式。
【6】Nature:特定的降血压药物或能增强癌症免疫疗法的疗效
doi:10.1038/s41586-023-06110-8
基于免疫检查点阻滞(ICB)的免疫疗法能使用抗体来诱导肿瘤的排斥反应,并未多种癌症类型患者带来临床治疗效益;然而,肿瘤通常会抵御免疫排斥反应,目前研究人员正在进行研究试图增加肿瘤的反应率是基于IDB和其它化合物的组合,旨在减少肿瘤微环境中的免疫抑制,但当作为单一疗法使用时通常效果并不大。近日,一篇发表在国际杂志Nature上题为“Tumour immune rejection triggered by activation of α2-adrenergic receptors”的研究报告中,来自Ludwig癌症研究所等机构的科学家们通过研究发现,此前用于治疗高血压的某些分子或能帮助机体免疫系统更好地靶向作用癌细胞,未来研究人员或有望大幅提高癌症免疫疗法的有效性和适用性。
研究者Benoit Van den Eynde说道,如今免疫疗法仅能有效对抗30%-40%的癌症,很多癌症对疗法具有一定的耐受性,主要是因为患者机体的T淋巴细胞并不能产生足够的反应;我们发现,曾经用于治疗高血压的药物或有望帮助抵御多种形式对免疫疗法耐受的癌症。免疫系统能通过破坏外来物质和病原体(比如细菌和病毒)来保护机体抵御疾病,作为一种白细胞,T淋巴细胞就是这一过程中的活性组分,其能识别并破坏看似外来的细胞。
然而,癌细胞并不是外来的,因此其通常并不会被T淋巴细胞所识别并攻击,但在大约30年前,研究者Thierry Boon及其同事就通过研究发现,癌细胞表面的特定标志物(肿瘤抗原)或能被T细胞识别,随后就会被T细胞所破坏。这项研究或为新型癌症免疫疗法的开发铺平了道路,癌症免疫疗法是一种新型疗法策略,其能帮助T细胞摧毁癌细胞,得益于T细胞的特异性和对肿瘤抗原的记忆,免疫疗法就会在治疗某些晚期癌症上取得一些成功,如今该疗法已经在全世界开始使用,然而,诸如此类疗法在治疗所有患者或抵御所有类型的癌症上并不同样有效。
【7】Nature:开发出有助于根除脊髓灰质炎的新型口服疫苗
doi:10.1038/s41586-023-06212-3
尽管开展了一些历史上最成功的国际疫苗接种活动,但脊髓灰质炎病毒(poliovirus)仍在世界各地流传,对未接种疫苗的人构成了神经系统损害甚至瘫痪的威胁。虽然野生型脊髓灰质炎病毒毒株已基本被消灭,但是在发展中国家中使用最多的口服脊髓灰质炎疫苗(oral polio vaccine, OPV)可以产生新的毒株。OPV使用的是弱化的活的脊髓灰质炎病毒,它们偶尔会发生突变变成活的病毒,从而在被认为已经消除了脊髓灰质炎的国家导致疫情爆发。
近日,一篇发表在国际杂志Nature上题为“Genetic stabilization of attenuated oral vaccines against poliovirus types 1 and 3”的研究报告中,来自美国加州大学旧金山分校和英国国家生物标准与控制研究所(NIBSC)的研究人员开发出两种新型口服脊髓灰质炎疫苗(novel oral polio vaccine, nOPV):nOPV1和nOPV3,以支持世界卫生组织(WHO)最近为最终消除脊髓灰质炎所做的努力,而在两年前WHO开始使用他们开发的第一种nOPV,即nOPV2。这些nOPV是50年来的第一批新的脊髓灰质炎疫苗。
与第一种nOPV一样,这项新研究中介绍的这两种最新的nOPV是由经过基因工程处理的弱化的脊髓灰质炎病毒制成的,以减少这种病毒发生突变而变成它的危险形式,Andino说,“由于国家内部和国家之间在疫苗接种方面的差异,脊髓灰质炎病毒一直持续到21世纪,有时还造成了悲惨的后果。我们利用多年来与脊髓灰质炎斗争的经验教训设计了这些新疫苗,并相信它们将有助于一劳永逸地消除这种疾病。”
【8】Nature:我国科学家分析了中国36个少数民族的基因组序列
doi:10.1038/s41586-023-06173-7
近日,一篇发表在国际杂志Nature上题为“A pangenome reference of 36 Chinese populations”的研究报告中,来自中国等多个国家的大型遗传工程师团队完成了为中国不同祖先的人构建泛基因组参考数据的计划的第一阶段。在他们的项目中,作为中国人群泛基因组联盟(Chinese Pangenome Consortium, CPC)的一部分,该团队试图对中国各地的少数民族群体的基因组进行测序。
CPC是在中国创建的,以解决全球医学界出现的一个问题---大多数基因组测序都涉及来自主要人口群体的人。例如,在中国,汉族是主要的民族,所以中国的大多数基因研究都是使用汉族的基因组进行的。这是一个问题,因为基因组的微小差异可能导致治疗失败,或在少数民族群体中造成意想不到的问题。CPC将它的工作分为几个阶段,第一阶段是选择一个少数民族群体的名单进行研究,然后对从该名单中的每个群体成员收集的组织进行测序和基因分析。
在第一阶段,该团队创建了一份36个少数民族的名单(目前中国有55个已知的少数民族),并从该名单上代表的58人身上收集了组织样本。随后,他们对所有的样本进行了测序,产生了116个基因组组装(每个人两个)。他们进行了单倍型分期(haplotype phasing),按亲缘关系对这些基因组组装进行分类。他们增加了1.89亿个碱基对的组装序列,这些序列在不同个体之间存在差异。他们还发现了1367个编码蛋白的重复序列。
doi:10.1038/s41586-023-06140-2
近日,一篇发表在国际杂志Nature上题为“Axonemal structures reveal mechanoregulatory and disease mechanisms”的研究报告中,来自美国哈佛医学院和英国伦敦大学学院等研究机构的研究人员首次获得了人类纤毛(cilia)---排列在我们的呼吸道上的微小的、像头发一样的突出物---结构的图像,这可能为罕见的纤毛疾病患者带来亟需的治疗。
这些作者结合了先进的显微镜和人工智能技术来获得人类纤毛结构的详细快照。作为细胞上的微观突起,纤毛排列在我们的肺部、耳朵和鼻窦内壁细胞的表面上,并有节奏地跳动,以保持肺部没有粘液和细菌。遗传了罕见的原发性纤毛运动障碍(primary ciliary dyskinesia, PCD)的人的纤毛有缺陷,不能有效地清除呼吸道中的碎片,因此遭受呼吸困难和慢性肺部感染。
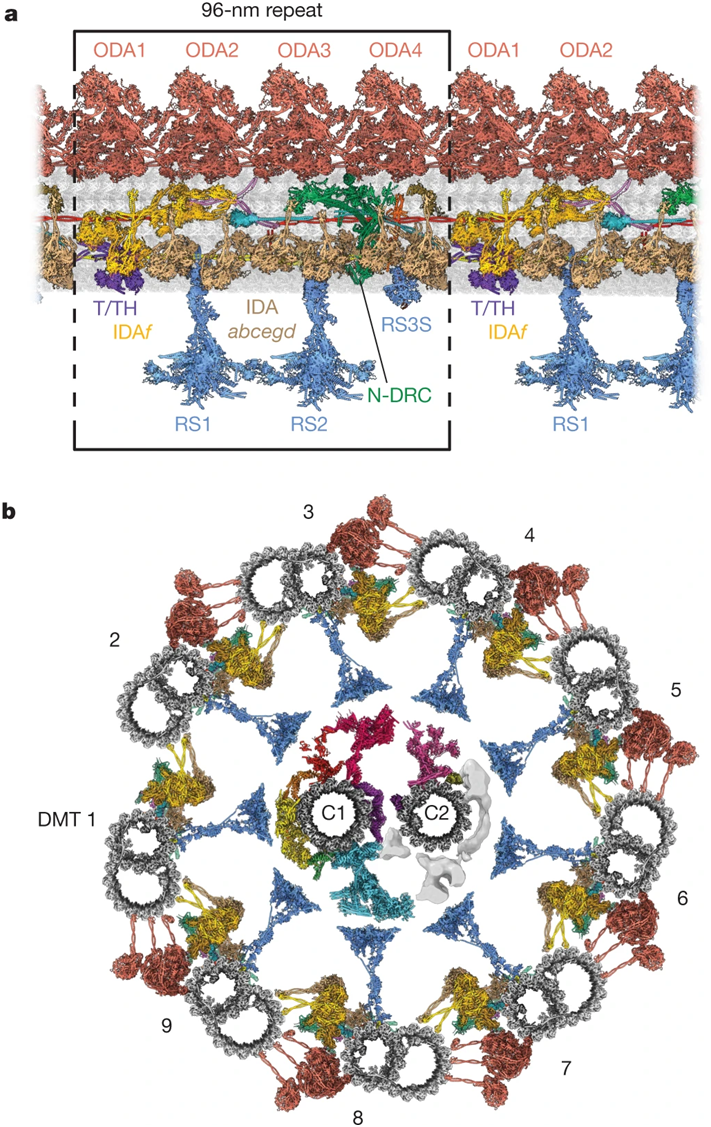
莱茵衣藻轴丝模块重复结构的原子模型。
图片来源:Nature, 2023, doi:10.1038/s41586-023-06140-2。
这些作者首次可视化观察导致纤毛跳动的分子“纳米机器”,沿着纤毛长度每隔96纳米就可以看到相同的结构。这些结构聚集在一起,形成了轴丝(axoneme)。在健康的气道中,这种复杂的结构受到严格的控制,分子被精确地安排,使纤毛以有节奏的、波浪式的运动跳动,每天跳动约100万次。在PCD患者中,这些作者发现纤毛不能正确地跳动,因为轴丝结构的关键成分缺失,这是由于基因突变造成的。这一新信息可能导致针对靶向这种缺陷的新药物,从而使纤毛正常跳动。
研究者Hannah Mitchison教授表示,目前治疗PCD的方法是清除人们的呼吸道并防止感染。我们的研究结果提供了开发可以精确地靶向轴丝的微小缺陷从而使纤毛按照它们应该的方式跳动的分子药物的可能性。分子药物正显示出对其他罕见疾病的希望,而针对COVID-19的研究已经开启了将这些药物直接递送到肺部的新方法。如果我们能将这些进展与我们的新发现结合起来,我希望我们能在未来5到10年内将分子药物带给PCD患者。
【10】Nature:重大进展!新研究揭示铜绿假单胞菌从慢性感染转变为急性感染的新机制
doi:10.1038/s41586-023-06111-7
免疫系统衰弱的人一直面临着感染的风险。作为一种常见的环境细菌,铜绿假单胞菌(Pseudomonas aeruginosa)可以在不同的身体部位(比如肺部)定植,导致持续的慢性感染,可以持续一生---这在囊性纤维化(cystic fibrosis)患者中很常见。但是,这种细菌有时会改变它们的行为并进入血液,导致慢性局部感染变成急性并可能是致命的。尽管几十年来在实验室环境中研究了这种转变,但这种转变如何以及为何在人类身上发生仍然是未知的。
近日,一篇发表在国际杂志Nature上题为“A Pseudomonas aeruginosa small RNA regulates chronic and acute infection”的研究报告中,来自美国佐治亚理工学院的研究人员确定了慢性和急性铜绿假单胞菌感染之间转变的主要机制。他们发现了一个驱动这种转变的基因。通过测量人体组织样本中的细菌基因表达,他们确定了这种转变的生物标志物。他们的发现可以为未来开发威胁生命的急性感染的治疗方法提供参考。
根据Whiteley和Cao的说法,细菌和动物一样,是多面手,并根据其环境表现出不同的行为。一个患有慢性感染的人可能有一天会很好,但身体的环境变化会导致细菌改变其行为。这可能会导致急性感染,一个人可能会出现需要立即治疗的败血症。Whiteley说,“多年来,人们一直在控制良好的实验室环境中研究这些细菌,尽管实验室是一个大多数微生物从未出现过的地方。我们的研究采取了一种新颖的方法,直接研究细菌在人类宿主中的行为。”
这些作者选择了研究慢性细菌性肺部和伤口感染的人体组织样本。利用基因测序技术,Whiteley和Cao测量了铜绿假单胞菌中存在的所有类型的mRNA水平。mRNA编码在细胞中发挥作用的蛋白,因此通过测量细菌的mRNA水平,人们可以推断出它的行为。虽然铜绿假单胞菌有大约6000个基因,但是Whiteley和Cao发现,有一个称为PA1414的基因在人体组织样本中的表达量比其他所有数千个基因的总和还要高。这种水平如此之高,以至于一开始,Cao和Whiteley认为PA1414 mRNA的高数量可能是人为造成的--与测序方法有关的故障。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


