近10年来膀胱过度活动症(OAB)口服新药!β3肾上腺素能受体激动剂Gemtesa在美国上市!
来源:本站原创 2021-04-13 03:02
Gemtesa是近10年首个新的口服品牌OAB药物。

2021年04月13日讯 /生物谷BIOON/ --Urovant Sciences是一家专注于开发和商业化泌尿系统疾病创新疗法的生物制药公司。近日,该公司宣布,在美国市场推出Gemtesa(vibegron,维贝格龙)75mg片剂,该药每日口服一次,用于治疗伴有急迫性尿失禁(UUI)、尿急、尿频症状的膀胱过度活动症(OAB)患者。
OAB成人患者可能会出现UUI、尿急和尿频等症状,这些症状对日常活动有很大影响。Gemtesa是一种口服、每天一次的片剂,每片含有75mg vibegron,这是一种小分子β3肾上腺素能受体激动剂,通过放松逼尿肌,使膀胱能容纳更多的尿液,从而减轻OAB的烦人症状。
Gemtesa于2020年12月获得美国FDA批准,标志着自2012年以来该机构批准的首个新的口服品牌OAB药物。此外,Gemtesa是第一个也是唯一一个在标签中有尿急数据和没有血压警告的β3激动剂。临床数据显示,在治疗第12周,与安慰剂相比,Gemtesa显著减轻了全部3种OAB关键症状,并且没有已知的β-3激动剂类相关的认知能力下降。
Gemtesa的处方信息中包含了明确显示尿急事件减少的数据,这在目前可用的OAB药物中是独一无二的。尿急事件减少数据对OAB患者及其医疗保健提供者尤其相关,因为这些数据表明Gemtesa对该病的标志性症状有直接影响。通过成功地治疗临床症状,Gemtesa可以让患者克服OAB对他们日常生活的破坏性影响。
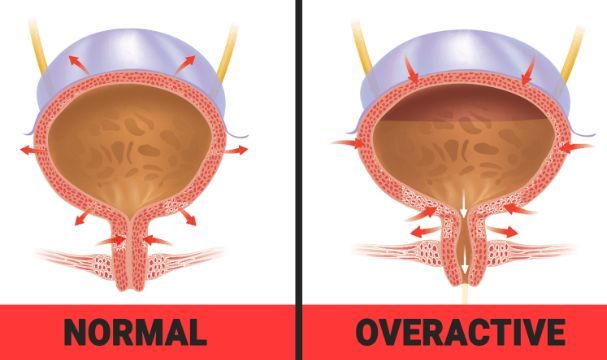
OAB(图片来源:powerofpositivity.com)
Gemtesa是第一种不需要剂量滴定的每日一次β3-激动剂,值得注意的是,在关键3期EMPOWUR研究中,与安慰剂相比,Gemtesa没有增加高血压的不良事件,并且与CYP2D6代谢的药物没有相互作用,这一点很重要,因为许多常见的药物都是由CYP2D6代谢的。
Gemtesa的监管批准,基于一项涉及4000多例OAB患者的广泛临床开发项目的结果,其中包括一项关键的12周双盲、安慰剂对照3期EMPOWUR研究(Gemtesa剂量为每日一次75mg)、双盲EMPOWUR长期扩展研究。在EMPOWUR研究中,数据显示,与安慰剂组相比,Gemtesa治疗组患者每日UUI、排尿和急症发作次数显著减少,排尿量增加。该研究中,发生在≥2%患者中的最常见不良反应是头痛、鼻咽炎、腹泻、恶心和上呼吸道感染。Gemtesa显示与安慰剂具有相同的高血压和血压升高不良事件发生率。

vibegron化学结构式(图片来源:newdrugapprovals.org)
Urovant Sciences总裁兼首席执行官Jim Robinson说:“Urovant很高兴向需要新的治疗方案来解决OAB烦人症状的患者和医疗保健提供者带来Gemtesa。该产品的上市,对Urovant来说是一个重要的里程碑,因为我们正在将我们的第一个产品推向市场。这也是整个泌尿学界的一个重要时刻,因为Gemtesa是近十年来第一个进入市场的口服OAB新药。”
泌尿专家联盟(Alliance Urology Specialists)泌尿科医师Scott a.MacDiarmid医学博士表示:“Gemtesa的上市是向前迈出的重要一步,为患者提供了一个安全、有效的治疗OAB症状的选择。Gemtesa将使我们能够提供以患者为中心的治疗体验,将一种新的β-3激动剂带到OAB治疗领域的前沿。”(生物谷Bioon.com)
原文出处:Urovant Sciences Announces U.S. Commercial Launch of GEMTESA (vibegron) 75 mg Tablets for Patients with Overactive Bladder
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


