2023年12月Science期刊精华
来源:生物谷原创 2023-12-31 19:24
2023年12月份即将结束,12月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年12月份即将结束,12月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:新研究表明要成功开发有效的HIV疫苗,可能需要促进CD8+T细胞产生的强烈的免疫反应
doi:10.1126/science.adg0514
在一项新的研究中,来自美国国家过敏与传染病研究所(NIAID)的研究人员发现有效的HIV疫苗可能需要促使称为CD8+T细胞的免疫细胞产生强烈反应,以保护人们免受HIV病毒感染。他们比较了过去的HIV疫苗研究参与者和即使在没有抗逆转录病毒疗法(ART)的情况下也能自然阻止HIV复制的HIV感染者---通常称为长期无进展者(long-term non-progressor, LTNP)或精英控制者(elite controller, EC)---的免疫系统活性。相关研究结果发表在2023年12月15日的Science期刊上,论文标题为“HIV vaccines induce CD8+ T cells with low antigen receptor sensitivity”。

图片来自Science, 2023, doi: 10.1126/science.adg0514。
当 HIV 进入人体后,这种病毒通过侵入 CD4+ T 细胞开始破坏免疫系统,其中CD4+ T 细胞是一种白细胞,有助于协调人体对病原体的免疫反应。在大多数人体内,除非通过ART加以控制,否则HIV会继续复制并损害越来越多的 CD4+ T 细胞。在 LTNP/EC中,免疫系统似乎能迅速识别携带 HIV 的 CD4+ 细胞,并激活称为 CD8+ T 细胞的免疫细胞。CD8+ T 细胞会消灭携带HIV的 CD4+ 细胞,从而抑制血液中的HIV。
有效的HIV疫苗旨在提供对HIV的持久保护性免疫力,或者如果最初的防御被绕过,则帮助长期控制体内的HIV,正如LTNP/EC中的那样。虽然有几种候选预防性HIV疫苗被设计成能刺激 CD8+ T 细胞活性,但在临床试验中它们并不能阻止HIV感染或控制病毒复制。了解和解决这种缺乏效果的问题是HIV疫苗研究的科学重点。
这些作者设计了他们的研究,以更好地了解以前的HIV疫苗接种者缺乏哪些 CD8+ T 细胞功能。他们将以前的 HIV 疫苗研究参与者的实验室样本与来自LTNP/EC的样本进行了比较。他们发现,HIV 疫苗接种者和 LTNP/EC都产生了大量能识别 HIV 的 CD8+ T 细胞。然而,与来自LTNP/EC的 CD8+ T 细胞不同的是,HIV 疫苗接种者的 CD8+ T 细胞无法提供必要的蛋白来消灭感染 HIV 的 CD4+ T 细胞。
进一步的测试表明,这种反应减弱的原因是疫苗接受者的 T 细胞受体---CD8+ T 细胞检测携带HIV 的 CD4+ T 细胞的部分---对 HIV 的敏感性降低。T细胞受体敏感性的降低表明,之前几项研究中的候选疫苗并没有充分刺激CD8+ T细胞的成熟,从而无法识别、到达并消灭人体内所有携带HIV的CD4+ T细胞。
2.Science:多样化的肠道细菌群落通过营养阻断来抵御有害健康的病原菌
doi:10.1126/science.adj3502
人体肠道内有数百种不同的细菌,它们统称为肠道微生物组(gut microbiome)。它们对健康的一大益处是保护肠道免受病原菌(致病微生物)的入侵,这些病原菌可能会引起有害的感染。但到目前为止,人们还不清楚这种保护作用是如何产生的,也不清楚某些细菌物种是否比其他细菌物种发挥着更重要的作用。
为了研究这个问题,来自英国牛津大学和法国斯特拉斯堡大学的研究人员在一项新的研究中对 100 种不同的肠道细菌菌株进行了单独和组合测试,以了解它们限制两种有害病原菌---肺炎克雷伯菌(Klebsiella pneumoniae)和肠道沙门氏菌(Salmonella enterica)---生长的能力。相关研究结果发表在2023年12月15日的Science期刊上,论文标题为“Microbiome diversity protects against pathogens by nutrient blocking”。
单种肠道细菌限制这两种病原菌传播的能力很差。但当多达 50 个肠道细菌物种的群落一起培养时,这两种病原菌的生长效率比任何单种肠道细菌培养时低 1000 倍。无论这些肠道细菌是在小瓶中一起培养,还是在“无菌”小鼠(实验开始时小鼠肠道中没有常驻细菌)中培养,这种“群落保护效应(community protection effect)”都可观察到。
然而,这些作者发现这些细菌群落的成员---而不仅仅是整体多样性---对保护水平有着至关重要的影响。他们发现,某些肠道细菌物种对基于群落的保护至关重要,尽管这些肠道细菌物种本身几乎不提供保护。
这些作者证实保护性细菌群落通过消耗病原菌所需的营养物来阻止病原菌生长。通过评估不同细菌物种的基因组,他们发现最具保护性的细菌群落是由蛋白组成与病原菌物种高度相似的细菌物种组成的。他们还利用代谢分析(metabolic profiling)证实保护性细菌物种对碳源的需求与病原菌相似。
3.Science:揭示CRISPR-Cas抗病毒防御系统抑制mRNA翻译机制
doi:10.1126/science.adj2107
在一项新的研究中,来自立陶宛维尔纽斯大学的研究人员利用生物信息学分析以及生化和结构研究,描述了一个名为Cami1的新型效应蛋白家族的特征。他们发现当称为噬菌体的细菌病毒攻击细菌时,CRISPR-Cas10 信号分子会激活 Cami1,即一种依赖于核糖体的核糖核酸酶。相关研究结果发表在2023年12月1日的Science期刊上,论文标题为“Ribosomal stalk-captured CARF-RelE ribonuclease inhibits translation following CRISPR signaling”。

图片来自Science, 2023, doi:10.1126/science.adj2107。
这些作者利用 X 射线结构分析和低温电镜(cryo-EM)确定了 apo-Cami1以及 Cami1 与蛋白合成机器(核糖体)结合在一起所形成的复合物的结构。通过结构研究,他们深入了解了Cami1如何特异性地切割mRNA。
他们指出Cami1与一种名为核糖体茎部(ribosomal stalk)的特殊核糖体结构相互作用是它进入蛋白合成中心所必需的。
Tamulaitis 说,“有趣的是,植物抗病毒蛋白也使用了同样的捕获机制来结合核糖体,从而使核糖体失活。这一发现揭开了CRISPR-Cas抗病毒防御系统的另一层面纱,并展示了真核生物和细菌共有的抗病毒策略。关于我们表征的 Cami1 蛋白的知识将有助于开发新的用于生物技术和治疗的分子工具。”
4.Science:新研究从全新角度探究形态发生素如何塑造器官发育
doi:10.1126/science.adg5579
在一项新的研究中,美国洛克菲勒大学形态发生实验室联合主任Alan Rodrigues和Amy Shyer领导的一个研究团队通过采用整体而非简化的方法来研究组织的形成,揭示了信号分子如何影响塑造发育中器官的生物物理过程。相关研究结果近期发表在Science期刊上,论文标题为“Morphogens enable interacting supracellular phases that generate organ architecture”。
这项新研究的基础是思维方式的根本转变,旨在为器官发育研究提供一个更广泛、更有意义的背景,甚至可能转化为对许多人类疾病更有效的诊断和治疗。
Rodrigues说,“推动我们大量研究工作的问题是,成千上万的细胞是如何聚集在一起生成组织中的有序模式的。我们的研究结果表明,除了分子和单个细胞之外,还有一种新兴秩序需要加以考虑。”
5.两篇Science揭示光解酶如何利用光来修复受损的DNA
doi:10.1126/science.adj4270; doi:10.1126/science.add7795
在两项新的研究中,两组研究人员开发了类似的过程,用于展示体外分离的光解酶(photolyase)如何利用光修复受损的 DNA。他们概述了他们的定格动画式过程,以详细捕捉它的作用。相关研究结果发表在2023年12月1日的Science期刊上,论文标题为“Time-resolved crystallography captures light-driven DNA repair”和“Visualizing the DNA repair process by a photolyase at atomic resolution”。

图片来自Science, 2023, doi:10.1126/science.adj4270。
先前的研究已表明,许多动物(虽然大多数不是哺乳动物)都进化出了一种修复被紫外线辐射损伤的DNA的过程---一种名为光解酶的蛋白能分离出受损的DNA,然后利用与光子相关的能量进行修复。虽然人们对这一过程有了大致的了解,但其中涉及的步骤却一直是个谜。在这两项新的研究中,这两组研究人员都开发出了一种捕捉瞬间动作的方法,在某些方面类似于制作电影的定格动画技术。
这两项新研究的出发点是:紫外线对 DNA 的破坏通常会导致将两条DNA链连接在一起的碱基对断裂。当发生这种情况时,相邻的碱基对会与其他断裂的DNA链结合,从而阻止 DNA 的自我修复。
在第一项新的研究中,第一组研究人员利用时间分辨晶体学实验捕捉了这一过程。在第二项新的研究中,第二组研究人员采用了一种包括时间分辨晶体学和计算分析的综合方法来捕捉这一过程。
这两组研究人员都是在光解酶开始工作时向其发射激光来记录这一过程。然后,每组研究人员发送 X 射线脉冲,以此捕捉每个步骤的动作。他们发现,光解酶的一部分形成了一个 V 型,使其能够捕获光子及其能量。该能量被用来将 V 型倒转,然后将电子转移到受损的 DNA 链上,从而破坏了不需要的键。这样就释放出一个电子,使光解酶回到直立的 V 位置,使其能够通过重新连接碱基对,协助在先前断裂的DNA链之间形成新的键。
6.Science:新研究揭示 EphA2 受体复杂行为背后的秘密
doi:10.1126/science.adg5314
在一项新的研究中,来自美国凯斯西储大学和Metro Health医院的研究人员成功揭开了一种蛋白受体--- EphA2---的神秘面纱,这种受体既能抑制癌症,也能促进癌症的生长和扩散。这一研究成果突显了 EphA2 受体如何以及为何会扮演抗击癌症和促进癌症的双重角色。相关研究结果发表在2023年12月1日的Science期刊上,论文标题为“Time-resolved live-cell spectroscopy reveals EphA2 multimeric assembly”。这项新的研究由凯斯西储大学医学院教授Bingcheng Wang领导。
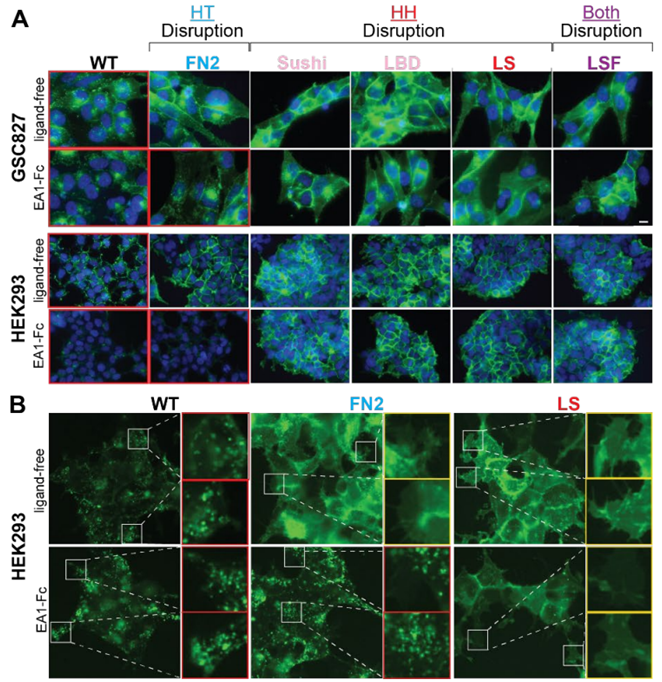
图片来自Science, 2023, doi:10.1126/science.adg5314。
如今,经过多年的研究,这些作者弄清了EphA2如何在癌症中扮演这些双重、相反的角色。他们利用前沿的光谱平台(PIE-FCCS)对活细胞进行分子分析,发现EphA2通过相邻EphA2分子间的两种相互作用自动组装成小簇,将它们“粘”在一起。其中一种相互作用有助于发挥抗击癌症的作用,而另一种相互作用则会触发它们的促进癌症作用。
论文共同作者、凯斯西储大学博士后学者Xiaojun Shi将分子成像专业知识与癌症生物学实验技能结合起来,使这一发现成为可能。凯斯西储大学医学院负责医疗事务的高级副院长John Chae谈到了这一发现的意义。
7.Science:新方法可确定T细胞和B细胞受体及其在组织中的位置
doi:10.1126/science.adf8486
在一项新的研究中,来自瑞典卡罗林斯卡医学院、瑞典皇家理工学院和瑞典科学生命实验室开发的一种新方法可以识别独特的免疫细胞受体及其在组织中的位置。他们预测,这种方法将提高识别哪些免疫细胞参与疾病过程的能力,并为开发针对许多疾病的新疗法开辟机会。相关研究结果发表在2023年12月8日的Science期刊上,论文标题为“Spatial transcriptomics of B cell and T cell receptors reveals lymphocyte clonal dynamics”。
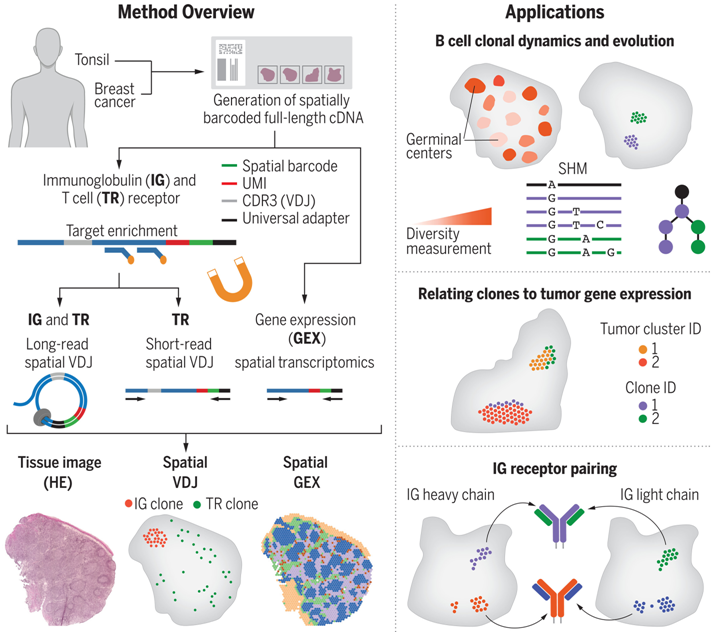
基于空间转录组学的B细胞和T细胞受体绘制方法。图片来自Science, 2023, doi:10.1126/science.adf8486。
T细胞和B细胞等免疫细胞是机体抵御感染和肿瘤的核心。这两种类型的免疫细胞都表达独特的受体,能专门识别细菌、病毒和肿瘤等不需要的外来物的不同部分。每种免疫细胞及其后代都有自己的特异性受体,每个人体内有数十亿种不同的免疫细胞,它们都有独特的受体。
在这项新的研究中,这些作者开发出一种方法,既能识别不同的 B 细胞和 T 细胞受体,又能揭示它们在人体组织中的位置。卡罗林斯卡医学院医学系助理教授Camilla Engblom说,“由于活化的免疫细胞通常在靠近它们攻击的目标的地方被发现,我们希望能够绘制出离肿瘤或感染最近的免疫细胞。使用以前的方法在微环境中识别B细胞和T细胞受体是不可能的。”
8.Science:重大进展!华人科学家开发出DVAP打印方法,可让超声波油墨凝固成不同的三维形状和结构
doi:10.1126/science.adi1563
在一项新的研究中,来自美国杜克大学和哈佛医学院的研究人员开发出一种生物相容性油墨(bio-compatible ink),它能通过吸收超声波凝固成不同的三维形状和结构。由于这种油墨对声波而非光线有反应,因此可用于深层组织的生物医学用途,比如从骨骼愈合到心脏瓣膜修复。相关研究结果发表在2023年12月8日的Science期刊上,论文标题为“Self-enhancing sono-inks enable deep-penetration acoustic volumetric printing”
在过去的几年里,为了规避这些问题,科学家们开发了一种光敏油墨,它能直接对目标光束做出反应,并迅速硬化成所需的结构。虽然这种打印技术能大幅提高打印速度和质量,但是人们只能使用透明油墨进行打印,而且生物医学用途也受到限制,因为光线不能到达组织内部超过几毫米的深度。
如今,哈佛医学院副教授 Y. Shrike Zhang 和杜克大学生物医学工程系副教授Junjie Yao开发出一种新的称为深穿透声学体积打印(deep-penetrating acoustic volumetric printing, DVAP)的打印方法,从而解决了这些问题。这种新技术采用了一种能对声波而不是光产生反应的专用油墨,使他们能够在前所未有的组织深度构建出生物医学有用的结构。
9.Science:突破性研究有望开发治疗皮肤自身免疫性疾病的新方法
doi:10.1126/science.adi8885
在一项新的突破性研究中,澳大利亚墨尔本大学的Laura Mackay教授领导的一个研究团队发现了控制不同类型免疫细胞的独特机制,并发现通过精确靶向这些机制,他们可以有选择性地清除“有问题的免疫细胞”,从而重塑皮肤的免疫景观。他们的研究结果揭示了在不影响抵抗感染和癌症的保护性免疫细胞的情况下清除导致皮肤自身免疫性疾病的免疫细胞的新方法。相关研究结果发表在2023年12月1日的Science期刊上,论文标题为“Divergent molecular networks program functionally distinct CD8+ skin-resident memory T cells”。
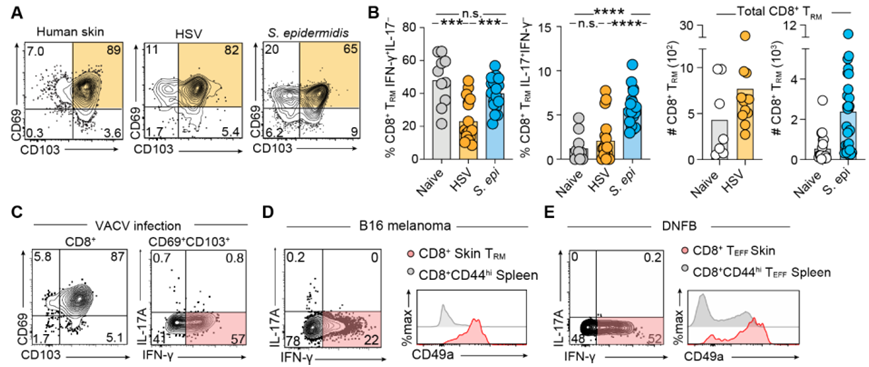
图片来自Science, 2023, doi:10.1126/science.adi8885。
我们的皮肤上布满了特化的免疫细胞,它们能抵御感染和癌症,促进伤口愈合。这些免疫细胞被称为组织驻留记忆T 细胞(Tissue-resident memory T, TRM 细胞),它们会留在皮肤中对抗感染和癌细胞。然而,如果控制不当,这些皮肤TRM细胞中的一些会导致自身免疫性疾病,如牛皮癣和白癜风。
论文共同第一作者、墨尔本大学的Simone Park博士说,这项新研究首次描述了在动物模型中控制各种类型皮肤TRM细胞的独特因素,为潜在的治疗策略提供了精确的靶标。Park博士说,“我们皮肤中的特化免疫细胞多种多样:许多特化免疫细胞对预防感染和癌症至关重要,但也有一些特化免疫细胞在介导自身免疫方面发挥着重要作用。我们发现了不同类型的皮肤TRM细胞受到调节的方式上的关键差异,这使我们能够有针对性地精确编辑皮肤的免疫景观。”
论文共同第一作者、墨尔本大学的Susan Christo博士解释了这些发现如何可能推动治疗皮肤病的努力。Christo博士说,“大多数自身免疫疗法都是治标不治本。治疗皮肤病的传统疗法通常会不加区分地影响所有免疫细胞,这意味着我们也可能会消灭我们的保护性T细胞。在此之前,我们还不知道如何将皮肤中‘坏的’T细胞与‘好的’保护性T细胞区分开来。通过这项新的研究,我们发现了新的分子,可以让我们有选择性地清除皮肤中致病的T细胞。”
10.Science:在怀孕期间,成年大脑中不同的神经干细胞池经激活后短暂地产生特定类型的嗅球神经元
doi:10.1126/science.abo5199
怀孕和做母亲会导致大脑重塑。在一项新的研究中,来自瑞士巴塞尔大学的研究人员通过对小鼠的实验发现,在怀孕期间,成年大脑中不同的神经干细胞池会被激活。他们指出,它们会产生特定类型的嗅球神经元。相关研究结果发表在2023年11月24日的Science期刊上,论文标题为“Pregnancy-responsive pools of adult neural stem cells for transient neurogenesis in mothers”。

图片来自Science, 2023, doi:10.1126/science.abo5199。
在这项新的研究中,这些作者发现,在小鼠体内,怀孕会导致不同神经干细胞池的同步激活,其中许多神经干细胞池通常处于休眠状态。这导致形成了其他罕见类型的神经元,这些神经元在出生前后被暂时添加到嗅球,即大脑中处理气味信息的部分。这些神经元能确保母体在早期当母亲期间识别自己的幼崽。
这些新的神经元具有重要作用。它们使母体的嗅觉更加灵敏,以便识别幼崽。在人类中,神经干细胞也存在于相同的脑区,不过在婴儿早期之后,它们通常不会制造嗅球神经元。
论文第一作者Zayna Chaker博士说,“一些女性报告说,她们在怀孕期间嗅觉发生了变化。类似的过程也可能发生在人类身上,休眠的神经干细胞会因怀孕而被激活。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


