2022年2月非编码RNA研究领域新进展
来源:本站原创 2022-02-28 19:26
2022年2月份非编码RNA相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
2022年2月份非编码RNA相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
【1】环状RNA Cwc27通过抑制Pur-α活性参与阿尔茨海默病的发病机制
doi:10.1038/s41418-021-00865-1
环状RNA (circRNAs)因参与多种生物学过程和涉及多种疾病而受到越来越多的关注。尽管阿尔茨海默病(AD)的差异表达circRNA图谱已经建立,但在基因表达和疾病相关认知方面,与AD直接相关的关键环状RNA的精确特征和功能尚不清楚。在本文中,研究者筛选并鉴定了circCwc27是一种与AD相关的新型环状RNA。CircCwc27是一种富含神经元的环状RNA,在大脑中大量表达,在AD小鼠和患者中显著上调。敲除circCwc27显著改善AD相关病理特征,改善认知功能障碍。在机制上,研究者排除了miRNA诱骗机制,重点研究了环状RNA - RNA结合蛋白(RBP)相互作用在AD中的重要作用。CircCwc27直接结合于富含嘌呤元素的结合蛋白A (Pur-α),增加了胞浆中Pur-α的保留,并抑制Pur-α招募到一组AD基因的启动子,包括淀粉样前体蛋白(app),多巴胺受体D1 (Drd1),蛋白磷酸酶1,调节抑制剂亚基1b (Ppp1r1b),神经营养酪氨酸激酶,受体,type 1 (Ntrk1)和LIM同源框8 (Lhx8)。circCwc27的下调增强了Pur-α与这些启动子结合的亲和力,导致Pur-α靶基因转录的改变。此外,Pur-α过表达在很大程度上抑制了circCwc27的表达,从而阻止了Aβ沉积和认知能力下降。总之,该研究结果表明,circRNA -蛋白相互作用的显著功能后果,circCwc27通过与调节蛋白Pur-α相结合,可能在AD发病机制中发挥关键作用,并代表了一个有临床翻译潜力的有前景的AD治疗靶点。
【2】设计的环状ADAR招募RNA提高了体外和体内RNA编辑的效率和保真度。
doi: 10.1038/s41587-021-01180-3
目前使用内源性ADAR酶和工程ADAR招募RNA (arRNAs)进行程序化RNA编辑的方法存在效率低和旁观者脱靶编辑的问题。在这里,研究者描述了LEAPER 2.0,这是LEAPER的更新版本,它使用了共价封闭的环状arRNAs,称为circ-arRNAs。研究者证明,在细胞中表达或在体外转录的环状RNA寡核苷酸中传递时,它们的编辑效率平均比线性同类高3.1倍。为了降低脱靶编辑,研究者删除了尿苷与脱靶腺苷的配对,这几乎完全消除了旁观者脱靶腺苷编辑。工程circ-arRNAs提高了细胞培养中内源性CTNNB1和突变型TP53转录本编辑的效率和保真度。在Hurler综合征小鼠模型中使用腺相关病毒递送circ-arRNAs,可以纠正致病性点突变,恢复α-L-iduronidase催化活性,降低肝脏中糖胺聚糖的积累。LEAPER 2.0提供了一种新的arRNA设计,能够实现更精确、更高效的RNA编辑,在治疗和基础研究中具有广泛的适用性。
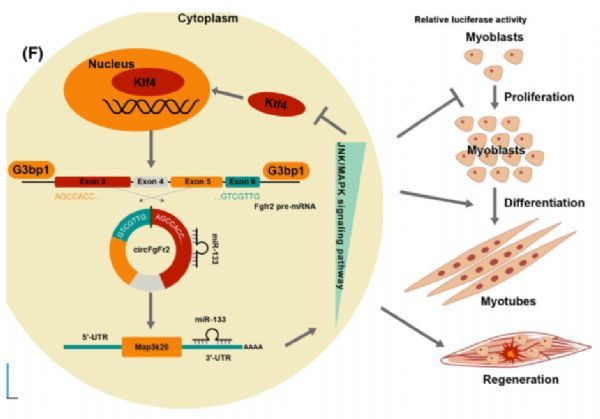
【3】circRNAome图谱显示circFgfr2通过反馈回路调节肌生成和肌肉再生
doi: 10.1002/jcsm.12859.
环状RNA (circRNAs)是一类由共价闭合环形成的新型非编码RNA,在许多生物过程中发挥着关键作用。已经报道了几种与肌生成相关的环状RNA。然而,circRNA在肌生成和骨骼肌发育过程中的动态表达、功能和机制仍不清楚。链特异性RNA测序(RNA-seq)和微阵列数据集被用来描绘骨骼肌发育和肌源性分化过程中的动态环状RNAome景观。生物信息学分析用于描述circRNAome并识别与肌生成相关的候选环状RNA。通过Bulk和单细胞RNA-seq鉴定circFgfr2的下游基因和通路。研究者分析了猪骨骼肌27个发育阶段的动态环状RNA,检测到52
918个高置信度环状RNA。其中2916个环状RNA在人类、小鼠和猪中是保守的,包括4个差异表达的环状RNA (circFgfr2、circQrich1、circMettl9和circCamta1)。研究者进一步关注了一种由成纤维细胞生长因子受体2 (Fgfr2)基因产生的保守环状RNA,称为circFgfr2,研究发现该环状RNA抑制成肌细胞增殖,促进分化和骨骼肌再生。在机制上,circFgfr2作为miR-133的海绵,调控丝裂原活化蛋白激酶激酶20 (Map3k20)基因和JNK/MAPK通路。本研究为骨骼肌的研究提供了一个全面的circRNA资源库。circFgfr2的功能和机制分析揭示了一个由circRNA介导的调节肌生成和肌肉再生的自调节反馈回路,这为进一步理解circRNA的调控机制提供了新的视角。
circFgfr2在调节骨骼肌发育过程中的作用机制
图片来源:
https://pubmed.ncbi.nlm.nih.gov/34811940/
【4】circPTEN1是由PTEN生成的环状RNA,通过抑制TGF-β/Smad信号通路来抑制癌症进展
doi: 10.1186/s12943-022-01495-y
PTEN是人类癌症中最常见的突变基因之一。虽然典型PTEN蛋白和PTEN亚型的作用已被广泛探讨,但目前对PTEN家族成员的了解还不能充分说明它们在生物过程和肿瘤发展中的多样性。值得注意的是,由PTEN产生的非编码RNA的功能尚未被阐明。研究者搜索circBase和circInteractome来分析PTEN生成环状RNA的潜力。然后通过Sanger测序、RNase
R和放线菌素D检测对circPTEN1的环结构进行验证。原位杂交和qRT-PCR检测circPTEN1在结直肠癌(CRC)肿瘤周围和肿瘤组织中的表达水平。此外,通过Transwell实验、三维多细胞肿瘤球形侵袭实验、转移模型等功能实验,利用circPTEN1敲除和过表达细胞株进行体外和体内实验,研究circPTEN1对结直肠癌肿瘤转移的影响。研究者发现了一个由PTEN基因生成的环状RNA,命名为circPTEN1,该RNA在结直肠癌中经常下调,circPTEN1的表达降低预示着较差的生存率。在PDX模型中,circPTEN1低表达可促进体内癌细胞转移,并在体外加速癌细胞侵袭,而circPTEN1过表达则显示出相反的作用。机制研究发现circPTEN1能够结合Smad4的MH2结构域,从而破坏其与Smad2/3的物理相互作用,减少Smad复合物的形成和随后的核易位,从而抑制其下游与TGF-β刺激下上皮-间质转化相关的基因表达。此外,研究者发现eIF4A3通过直接结合到circPTEN1的侧面区域,抑制了circPTEN1的环化作用。研究者的研究发现了一种由PTEN基因生成的具有肿瘤抑制功能的新型环状RNA,进一步揭示了circPTEN1在TGF-β介导的CRC转移中的作用机制。circPTEN1的发现为PTEN的研究提供了一个新的方向,而阐明circPTEN1/TGF-β/Smad信号通路可能为开发一种潜在的抑制肿瘤进展的治疗策略铺平道路。
【5】Exosomal
circLPAR1通过METTL3-eIF3h相互作用抑制BRD4,从而在结直肠癌诊断和肿瘤发生中发挥作用
doi:10.1186/s12943-021-01471-y
外泌体已成为多种癌症的重要生物标志物,并含有丰富的环状RNA (circRNAs)。然而,外泌体环状RNA用于诊断的潜力及其在结直肠癌(CRC)中的分子作用机制仍不清楚。CRC特异性外泌体环状RNA通过RNA测序、exoRBase数据库和组织芯片鉴定。在无癌对照组、癌前个体、CRC患者和其他类型癌症患者中评估血浆外泌体环状RNA的诊断性能。相应的生物学功能主要通过circRNA下拉、蛋白质组学分析和RNA免疫沉淀等方法进行评估。CircLPAR1包裹在外泌体中,具有很高的稳定性和可检测性,其在血浆外泌体中的表达在CRC发展过程中显著降低,但在术后恢复。Exosomal circLPAR1结合常见的临床生物标志物CEA和CA19-9分析其表现,在CRC诊断中表现出癌特异性,并将其诊断效能提高到受试者工作特征曲线下的面积0.875。此外,circLPAR1在CRC组织中下调,并与总生存率相关。机制上,外泌体circLPAR1被CRC细胞内化,并抑制肿瘤生长,这可能是因为直接与eIF3h结合的外泌体circLPAR1特异性抑制了METTL3-eIF3h的相互作用,减少了癌基因BRD4的翻译。这项全面的研究强调血浆外泌体circLPAR1在CRC诊断中是一个有前途的预测因子,并描述了其在结直肠肿瘤发生中的生物学调节。本研究为临床早期诊断和疾病发展的发病机制提供了新的视角。
【6】细胞核基因组来源的环状RNA
circPUM1定位于线粒体并调节食管鳞状细胞癌的氧化磷酸化
doi:10.1038/s41392-021-00865-0
环状RNA (circRNAs)被证明在肿瘤的发生和发展中发挥重要作用。然而,定位于肿瘤细胞线粒体的核基因组来源环状RNA的功能仍未明确。在这里,研究者报道了circPUM1,一个来自核基因组PUM1前mRNA后剪接的环状RNA,定位于线粒体。食管鳞状细胞癌(ESCC)细胞系中circPUM1的表达水平与cocl诱导的细胞内缺氧样条件下hf1 α的积累呈正相关。重要的是,circPUM1在ESCC细胞系中作为UQCRC1和UQCRC2相互作用的支架。circPUM1的敲除分别导致细胞内氧浓度降低、氧化磷酸化下调、线粒体膜电位降低、ROS生成增加和线粒体收缩。CircPUM1缺失可诱导线粒体复合体III功能障碍和caspase3的自发裂解。有趣的是,circPUM1的破坏导致细胞焦亡,从而引发ESCC细胞系的细胞死亡。因此,研究者得出结论,circPUM1在维持线粒体复合体III的稳定性以增强ESCC细胞ATP生成的氧化磷酸化中发挥了关键作用,并进一步提出,ESCC细胞在细胞适应过程中利用了circPUM1。
【7】CircOGDH是急性缺血性中风的生物标志物和治疗靶点。
doi:10.1161/CIRCRESAHA.121.319412
急性缺血性中风(AIS)是世界范围内致残和死亡的主要原因。预测AIS后半暗区是否存在是决定再灌注治疗的关键。然而,一种快速、廉价、简单、无创的具有临床转译潜力的中风后半暗区预测生物标志物仍然缺乏。研究者的目的是研究CircOGDH(源自氧戊二酸脱氢酶的环状RNA)是否是AIS患者半暗带的潜在生物标志物,以及其在缺血性神经元损伤中的作用。从大脑中动脉闭塞小鼠的半暗区中筛选CircOGDH,采用定量聚合酶链反应(quantitative polymerase
chain reaction)检测AIS患者血浆中的CircOGDH。磁共振成像用于检查半影体积。通过荧光原位杂交、RNA免疫沉淀和荧光素酶报告试验检测初级皮层神经元中CircOGDH与miR-5112相互作用。AD介导的CircOGDH敲低可改善COL4A4(鸡胶原,型,α VI)过表达诱导的神经元凋亡。透射电镜、纳米颗粒跟踪分析和Western blot检测外泌体。CircOGDH表达在大脑中动脉闭塞小鼠的半影组织和45例AIS患者的血浆中显著和选择性地上调,AIS患者的血浆比非脑血管疾病对照组增强54倍。部分回归分析显示,AIS患者CircOGDH表达与半暗区大小呈正相关。通过CircOGDH隔离miR-5112可增强COL4A4的表达,从而提高神经元损伤。此外,在缺血条件下,CircOGDH的下调显著提高了神经元细胞的生存能力。此外,CircOGDH在脑组织中的表达与大脑中动脉闭塞小鼠血清中的表达密切相关。最后,研究者发现,与非脑血管疾病患者相比,AIS患者血浆外泌体中CircOGDH高表达。这些结果表明,CircOGDH是调节缺血神经元活力的潜在治疗靶点,在外周血中富含神经元来源的外泌体,在AIS患者中显示出半暗带的预测性生物标志物。
CoCl2诱导的细胞内缺氧样微环境模型建立
图片来源:
doi:10.1038/s41392-021-00865-0
【8】EBV miRNAs BART11和BART17-3p通过增强子介导的PD-L1转录促进免疫逃逸
doi:10.1038/s41467-022-28479-2
EB病毒(Epstein-Barr
virus, EBV)是最早发现的人类肿瘤病毒,与鼻咽癌(NPC)、胃癌(GC)及多种淋巴瘤的发生发展密切相关。EBV阳性的鼻咽癌和胃癌组织中PD-L1表达升高;然而,EBV依赖促进PD-L1表达诱导免疫逃逸的具体机制有待阐明。EBV编码44个成熟miRNA。在本研究中,研究者发现EBV-miR-BART11和EBV-miR-BART17-3p在EBV相关的鼻咽癌和胃癌中上调PD-L1的表达。此外,EBV-miR-BART11靶向FOXP1, EBV-miR-BART17-3p靶向PBRM1, FOXP1和PBRM1结合PD-L1增强子区域抑制其表达。因此,EBV-miR-BART11和EBV-miR-BART17-3p分别抑制FOXP1和PBRM1,增强PD-L1的转录,从而促进肿瘤免疫逃逸,为EBV相关的肿瘤免疫治疗提供了潜在靶点。
【9】人类癌症中的lncRNA:来自噪音的信号
doi: 10.1016/j.tcb.2022.01.006
鉴于生化反应的随机性,导致生物功能不受噪声影响的机制是模糊的。非保守基因组区域的普遍转录产生低表达的癌症特异性长非编码RNA (lncRNAs)。这种通常在正常组织中无法检测到的低表达转录本是如何持续调节多种丰富蛋白质的活性从而导致癌症表型的,目前还不清楚。通过液-液相分离(LLPS)对环境振荡的生化反应划分可以解释从分子噪声中出现的秩序。lncRNA包含重复序列,因此有助于分子聚集和LLPS。研究者提出lncRNAs通过调节异常的LLPS介导癌症应激信号。这种新出现的模型及其对化学计量学和特异性的影响可能会导致诊断工具和癌症特异性药物的发展。
【10】阻断miR-143/-145簇介导的促纤维化反应增强了对黑色素瘤靶向治疗的反应
doi: 10.15252/emmm.202115295
向间充质样状态的谱系脱分化显示肌成纤维细胞和纤维化特征是黑色素瘤靶向治疗的适应性和获得性耐药的常见机制。在本研究中,研究者发现抗纤维化药物尼达尼布在黑色素瘤临床前模型中能够使纤维ECM网络正常化,增强MAPK靶向治疗的疗效,并延迟肿瘤复发。这种耐药表型的获得及其通过尼达尼布的逆转表明,miR-143/-145促纤维化簇是这种间质样表型的驱动因素。在体外和体内观察到,在BRAFi/MAPKi治疗下,黑色素瘤细胞中miR-143/-145簇上调,并与侵袭性/未分化特征相关。该簇中产生的2个成熟miRNAs miR-143-3p和miR-145-5p通过靶向fasin actin- bundle protein 1
(FSCN1)介导向耐药未分化间充质样状态的过渡,调节肌动蛋白细胞骨架和ECM之间的动态串扰,通过调节黏着灶动力学和机械转导途径。研究者的研究揭示了一种新的miRNA介导的调控网络,它有助于非遗传适应性耐药,并提供了原理证明,防止MAPKI诱导的促纤维化间质反应是靶向治疗患者的一个可行的治疗机会。
生物谷2022年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。