针对新冠病毒SARS-CoV-2/COVID-19,Cell期刊研究进展一览(第6期)
来源:本站原创 2020-11-30 23:34
2020年11月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭
2020年11月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的 症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Cell期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Cell:从轻度新冠中恢复的人体可维持新冠病毒特异性的免疫记忆至少3个月
doi:10.1016/j.cell.2020.11.029
在一项新的研究中,来自美国华盛顿大学医学院等研究机构的研究人员对从轻度COVID-19中恢复的个体进行了纵向评估,以确定他们是否产生和维持多方位的SARS-CoV-2特异性免疫记忆。这些康复的个体产生了SARS-CoV-2特异性IgG抗体、中和血浆、记忆B细胞和记忆T细胞,并持续了至少三个月。相关研究结果于2020年11月23日在线发表在Cell期刊上,论文标题为“Functional SARS-CoV-2-specific immune memory persists after mild COVID-19”。
这些作者的数据进一步显示产生SARS-CoV-2特异性IgG的记忆B细胞随时间的增加而增加。此外,SARS-CoV-2特异性记忆淋巴细胞表现出与强效抗病毒功能相关的特征:记忆T细胞分泌细胞因子,并在抗原再次遇到时发生增殖,而记忆B细胞表达的受体当以单克隆抗体表达时能够中和病毒。
2.Cell论文详解在SARS-CoV-2感染和细胞因子休克综合征中,TNF-α和IFN-γ引发炎症细胞死亡、组织损伤和死亡机制
doi:10.1016/j.cell.2020.11.025
OVID-19大流行继续导致重大疾病和死亡,而治疗方案仍然有限。在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员发现了一种潜在的策略,可以防止COVID-19患者出现危及生命的炎症、肺部损伤和器官衰竭。相关研究结果于2020年11月18日在线发表在Cell期刊上,论文标题为“Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes”。
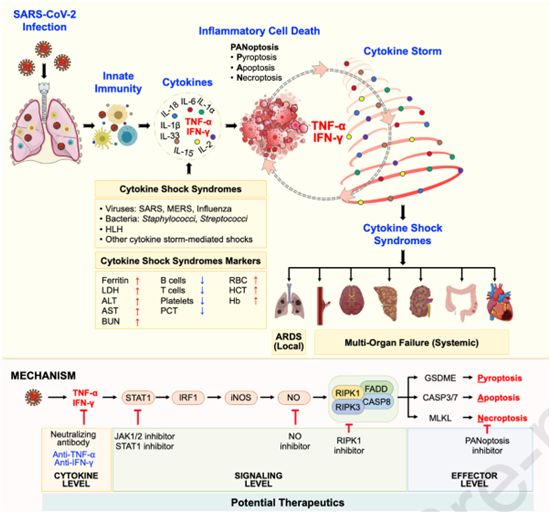
这些作者在发现与COVID-19相关的过度炎症免疫反应通过触发炎症细胞死亡途径导致小鼠组织损伤和多器官衰竭后,确定了候选药物。他们详细介绍了炎症细胞死亡信号通路如何发挥作用,从而有助于开发潜在的治疗方法来破坏这一过程。
论文通讯作者、圣犹大儿童研究医院免疫学系副主任Thirumala-Devi Kanneganti博士说,“了解驱动这种炎症的途径和机制对于开发有效的治疗策略至关重要。这项研究提供了这种理解。我们还确定了激活炎症细胞死亡途径的特异性细胞因子,在治疗COVID-19和包括败血症在内的其他高致命性疾病方面具有相当大的潜力。”
3.Cell:评估SARS-CoV-2刺突蛋白突变D614G对传播性和致病性的影响
doi:10.1016/j.cell.2020.11.020
在一项新的研究中,来自英国卡迪夫大学、 爱丁堡大学和帝国理工学院等研究机构的研究人员评估了1月至6月间在英国收集的2.5万多份SARS-CoV-2全基因组序列。与其他地方一样,614G在英国3月下旬成为主导的变体,这种614G变体经过多次独立引入,大多来自曾在国际上旅行的人。他们还证实,614G与感染严重程度无关,并观察到年轻患者更容易感染614G,且病毒载量更高。他们的结研究果支持这样的一个观点:614G是阳性选择,很可能影响这种病毒的传播性。相关研究结果于2020年11月18日在线发表在Cell期刊上,论文标题为“Evaluating the effects of SARS-CoV-2 Spike mutation D614G on transmissibility and pathogenicity”。
论文共同作者、英国卡迪夫大学遗传流行病学家Thomas Connor告诉《科学家》杂志,“即使有了这个庞大的数据集,我们几乎已经突破了识别这种影响存在的能力极限。”如果样本量较小,检测如此微小的传染性变化将更加困难。
4.Cell:我国科学家揭示新冠病毒复制转录复合体的低温电镜结构
doi:10.1016/j.cell.2020.11.016
SARS-CoV-2 mRNA的转录需要由复制转录复合体(replication and transcription complex, RTC)促进的一系列反应。
在一项新的研究中,来自中国清华大学、上海科技大学和武汉大学的研究人员展示了SARS-CoV-2 RTC向cap结构合成过渡时的结构快照。他们解析出由nsp7-nsp82-nsp12-nsp132-RNA和单个RNA结合蛋白(即nsp9)组装而成的扩展RTC在原子分辨率下的低温电镜结构。相关研究结果于2020年11月14日在线发表在Cell期刊上,论文标题为“Cryo-EM Structure of an Extended SARS-CoV-2 Replication and Transcription Complex Reveals an Intermediate State in Cap Synthesis”。
5.Cell:巴瑞替尼可降低新冠病毒感染的恒河猴中的炎症
doi:10.1016/j.cell.2020.11.007
SARS-CoV-2诱导的高细胞因子血症(hypercytokinemia)和炎症与COVID-19的疾病严重程度密切相关。作为一种临床批准的JAK1/2抑制剂,巴瑞替尼(baricitinib)目前正在COVID-19临床试验中进行研究。在一项新的研究中,来自美国埃默里大学的研究人员研究了巴瑞替尼在SARS-CoV-2感染的恒河猴模型中的免疫学和病毒学疗效。这种恒河猴模型模拟了在COVID-19患者中观察到的炎症特征。相关研究结果于2020年11月9日在线发表在Cell期刊上,论文标题为“Baricitinib treatment resolves lower airway macrophage inflammation and neutrophil recruitment in SARS-CoV-2-infected rhesus macaques”。
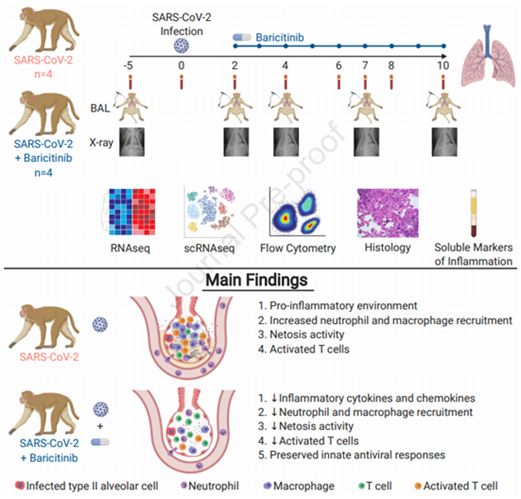
从鼻腔拭子、咽喉拭子、支气管肺泡灌洗液和组织中测得的病毒脱落并没有因为使用巴瑞替尼而减少。不过,巴瑞替尼可抑制肺部巨噬细胞中促炎细胞因子的产生。I型IFN抗病毒反应和SARS-CoV-2特异性T细胞反应在两组接受巴瑞替尼治疗的恒河猴中保持相似。接受巴瑞替尼治疗的恒河猴显示炎症减少、肺部炎症细胞浸润减少、中性粒细胞捕获网(NETosis)活性降低,肺部病理更为有限。这表明在接受巴瑞替尼治疗的恒河猴中,这种药物保持了先天性抗病毒反应和SARS-CoV-2特异性T细胞反应。
6.Cell:详解一例神奇的病例!一名女性白血病患者感染新冠病毒后至少70天仍在脱落传染性病毒颗粒
doi:10.1016/j.cell.2020.10.049
大多数感染SARS-CoV-2冠状病毒的人似乎会在8天左右的时间里活跃地脱落传染性病毒,但人与人之间的差异性很大。了解人们能在多长时间内保持活跃感染是很重要的,这是因为它提供了关于一种仍然没有很好地理解的疾病和病毒的新细节,这有助指导公共卫生决策。在一项新的研究中,来自美国国家卫生院(NIH)、马歇尔大学和英国牛津大学等研究机构的研究人员报告了一个不寻常的案例:一名患有白血病和具有低抗体计数的女性感染这种冠状病毒至少105天,保持传染性至少70天,然而她在整个过程中一直没有症状。相关研究结果于2020年11月4日在线发表在Cell期刊上,论文标题为“Case Study: Prolonged infectious SARS-CoV-2 shedding from an asymptomatic immunocompromised cancer patient”。
论文共同通讯作者、美国国家过敏与传染病研究所(NIAID,为NIH的一个下属机构)病毒学家Vincent Munster说,“在我们开始这项研究的时候,我们对病毒脱落的持续时间确实了解不多。随着这种病毒的持续传播,更多患有一系列免疫抑制性疾病的人将会被感染,了解SARS-CoV-2在这些人群中的表现非常重要。”
7.Cell:揭示受损的功能性体液免疫反应与COVID-19死亡率密切相关
doi:10.1016/j.cell.2020.10.052
为了充分确定保护性体液免疫反应,来自美国拉根研究所、麻省理工学院、哈佛医学院和麻省总医院的研究人员在一项新的研究中剖析了193名患有中度到重度COVID-19的住院患者的体液免疫反应的早期演变。相关研究结果于2020年11月3日在线发表在Cell期刊上,论文标题为“Compromised humoral functional evolution tracks with SARS-CoV-2 mortality”。
尽管患有重度COVID-19的存活者(survivor)和非存活者(non-survivor)都进化出了强健的IgM和IgA反应,但非存活者表现出减弱的IgG反应,同时伴有受损的Fcɣ受体结合和Fc效应活性,这表明体液免疫反应发育不完善,不过他们并未产生增强疾病的体液免疫反应。相反,患有中度COVID-19的患者表现出延迟的体液免疫反应,但是所表现出的体液免疫反应最终会发育成熟。
8.Cell:令人关注!大约20%的新冠肺炎患者在三到四个月内维持抗病毒抗体产生
doi:10.1016/j.cell.2020.10.051
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。关于COVID-19的一个迫切问题依然存在:免疫力能持续多久?免疫力的一个关键指标是病毒特异性抗体的存在。关于从感染中康复的人是否能维持潜在的保护性抗体,以前的研究提供了相互矛盾的说法。
在一项新的研究中,来自美国布莱根妇女医院等研究机构的研究人员检查了来自从轻度到中度COVID-19中康复的患者的血液样本和细胞,发现虽然大多数患者在疾病消退后抵抗这种病毒的抗体下降,但是有一部分患者在感染后几个月内持续产生抗病毒抗体。这些抗体“维持者(sustainer)”的症状过程较短,这表明一些从COVID-19中恢复较快的患者可能对这种病毒产生了更有效和持久的免疫反应。相关研究结果于2020年11月3日在线发表在Cell期刊上,论文标题为“Quick COVID-19 Healers Sustain Anti-SARS-CoV-2 Antibody Production”。
9.Cell:揭示轻度和中度COVID-19疾病状态之间的急剧变化
doi:10.1016/j.cell.2020.10.037
在一项新的研究中,来自美国拉根研究所、麻省理工学院、哈佛医学院和麻省总医院的研究人员对139名不同疾病严重程度的COVID-19患者的临床测量结果、免疫细胞和血浆多组学(plasma multi-omics)数据进行了综合分析,这些患者是在确诊后的第一周期间接受连续采血。相关研究结果近期发表在Cell期刊上,论文标题为“Multi-omics resolves a sharp disease-state shift between mild and moderate COVID-19”。

这些研究人员鉴定出轻度COVID-19和中度COVID-19之间的一个主要转变,在这个转变点,炎症信号的升高伴随着特定类代谢物和代谢过程的丧失。在中度COVID-19患者的这种应激的血浆环境中,出现了多种不同寻常的免疫细胞表型,并这些表型随着疾病严重程度的增加而放大。他们将120000多种免疫特征浓缩成一个轴,以捕捉不同免疫细胞类型如何协调对SARS-CoV-2感染作出反应。这个免疫反应轴(immune-response axis)独立地与主要血浆成分变化、临床凝血指标以及从轻度COVID-19到中度COVID-19的急剧转变相一致。这项研究表明,中度COVID-19可能为治疗干预提供最有效的环境。
10.Cell:重大进展!包括新冠病毒在内的β冠状病毒利用溶酶体劫持和离开受感染细胞
doi:10.1016/j.cell.2020.10.039
在一项新的研究中,来自美国国家卫生研究院(NIH)的研究人员发现了一种生物途径,当包括SARS-CoV-2在内的β冠状病毒在体内传播时,它们似乎可以利用这种生物途径劫持和离开细胞。更好地了解这一重要途径可能会在阻止这种导致COVID-19疾病的SARS-CoV-2冠状病毒的传播方面提供了重要的新见解。相关研究结果于2020年10月27日在线发表在Cell期刊上,论文标题为“β-Coronaviruses use lysosomes for egress instead of the biosynthetic secretory pathway”。
在细胞研究中,这些作者首次发现,β冠状病毒可以通过溶酶体---一种称为细胞“垃圾粉碎机(trash compactor)”的细胞器---离开受感染的细胞。通常情况下,溶酶体会在病毒和其他病原体离开细胞之前将它们摧毁。然而,这些作者发现,β冠状病毒会使得溶酶体的抗病机制失活,从而允许它在体内自由传播。靶向这种溶酶体途径有可能导致人们开发新的、更有效的抗病毒疗法来对抗COVID-19。
11.Cell:通过CRISPR筛选鉴定出抵抗新冠病毒感染的基因和药物靶标
doi:10.1016/j.cell.2020.10.030
在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭示了人类基因组中的哪些基因和基因调控网络是SARS-CoV-2感染所需的,抑制这些基因赋予了对这种冠状病毒感染的抵抗力。他们描述了一系列以前没有被认为是SARS-CoV-2治疗靶点的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Identification of required host factors for SARS-CoV-2 infection in human cells”。
为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。
12.Cell:全基因组CRISPR筛选鉴定出对新冠病毒感染至关重要的宿主因子
doi:10.1016/j.cell.2020.10.028
在一项新的研究中,来自美国耶鲁大学和布罗德研究所等研究机构的研究人员对暴露于SARS-CoV-2和MERS-CoV冠状病毒的数亿个细胞进行了筛选,鉴定出几十个能使这两种病毒在细胞中复制的基因,也鉴定出一些似乎抑制这些病毒的基因。他们表示,这些基因的促病毒作用和抗病毒作用将有助于指导科学家们开发新的疗法来对抗COVID-19。相关研究结果近期发表在Cell期刊上,论文标题为“Genome-wide CRISPR screens reveal host factors critical for SARS-CoV-2 infection”。
在这项新的研究中,这些研究人员对绿猴细胞进行了全基因组CRISPR筛选,其中与常用的人类细胞系相比,绿猴细胞在暴露于SARS-CoV-2后更容易死亡。这种筛选首次允许他们同时跟踪病毒和细胞之间的相互作用。这种筛选证实了早先的发现,即编码细胞表面受体的ACE-2基因能促进SARS-CoV-2感染宿主细胞。
然而,这种筛选还发现了两种新的促病毒蛋白复合物和第三种似乎有助于阻止感染的蛋白复合物。他们发现,能开启和关闭基因的SWI/SNF复合物和具有包括调节炎症在内的许多功能的HMGB1与感染后细胞死亡增加有关。
这些研究人员随后加入了抑制已发现的这两种基因产物功能的小分子药物,并发现它们可以增加培养皿中的细胞在感染后的存活率。相比之下,有助于调节细胞核内基因表达的组蛋白H3复合物似乎提供了一种保护作用,这会抑制SARS-CoV-2感染和杀死细胞的能力。
13.Cell:感染新冠病毒的人类和恒河猴肺部组织出现内皮破坏和血管血栓形成
doi:10.1016/j.cell.2020.10.005
在一项新的研究中,来自美国贝斯以色列女执事医疗中心和拉根研究所等研究机构的研究人员证实了来自感染SARS-CoV-2的人类和恒河猴的肺部组织病理切片中出现内皮破坏和血管血栓形成。相关研究结果近期发表在Cell期刊上,论文标题为“Vascular Disease and Thrombosis in SARS-CoV-2-Infected Rhesus Macaques”。
为了确定与SARS-CoV-2在恒河猴中发病相关的关键分子途径,这些研究人员对支气管肺泡灌洗液和外周血进行了转录组分析,并对血清进行了蛋白质组分析。他们观察到肺部有巨噬细胞浸润,巨噬细胞、补体、血小板活化、血栓形成和促炎症标志物上调,包括C反应蛋白、MX1、IL-6、IL-1、IL-8、TNFα和NF-κB。
14.Cell:揭示新冠病毒破坏人体细胞的剪接、翻译和蛋白运输,从而抑制人体抗病毒防御
doi:10.1016/j.cell.2020.10.004
如今,在一项新的研究中,来自美国加州理工学院和佛蒙特大学等研究机构的研究人员确定了SARS-CoV-2病毒让人体细胞丧失能力的机制:这基本上使得人体细胞的报警系统失效,从而无法呼救附近细胞的帮助,也无法提醒附近细胞存在感染。了解这种病毒如何导致细胞水平上的功能障碍,为如何对抗它提供了新的见解。相关研究结果于2020年10月8日在线发表在Cell期刊上,论文标题为“SARS-CoV-2 disrupts splicing, translation, and protein trafficking to suppress host defenses”。论文通讯作者为加州理工学院生物学教授Mitchell Guttman博士和佛蒙特大学医学院研究员Devdoot Majumdar博士。
SARS-CoV-2病毒会产生大约30种病毒蛋白。在这项新的研究中,Guttman实验室检查了其中的每一种,并绘制了它们如何与实验室培养皿中培养的人体细胞内的分子成分相互作用。他们发现SARS-CoV-2蛋白会攻击三个关键的细胞过程,以破坏人类蛋白的产生。
论文共同第一作者、佛蒙特大学的Emily Bruce说,“病毒太了不起了。病毒和宿主细胞不断进行进化军备竞赛,以战胜对方。SARS-CoV-2已进化出复杂而特殊的方法来使宿主细胞丧失功能,而不会直接杀死它们,这样这种病毒仍然可以利用宿主细胞达到它自己的目的。”
15.Cell:首次详细概述人体CD4+ T细胞对新冠病毒的反应
doi:10.1016/j.cell.2020.10.001
随着世界各地的科学家们开发出拯救生命的COVID-19疫苗和药物,许多人仍然想知道究竟为什么这种疾病在一些人身上是致命的,而在另一些人身上是轻微的。为了解决这个难题,科学家们需要深入了解人体多种类型的免疫细胞如何应对SARS-CoV-2,即导致COVID-19疾病的冠状病毒。
在一项新的研究中,来自美国拉霍亚免疫学研究所、英国利物浦大学和南安普顿大学等研究机构的研究人员首次详细概述了人体的CD4+ T细胞如何应对SARS-CoV-2病毒。除此之外,他们的研究还表明,在患病早期,住院的重症COVID-19患者会产生一种有可能杀死B细胞和减少抗体产生的新型T细胞亚群。这些发现为进一步的详细分析提供了重要的基础,并展示了一种称为单细胞RNA测序(RNA-seq)的前沿技术的力量。相关研究结果于2020年10月5日在线发表在Cell期刊上,论文标题为“Imbalance of regulatory and cytotoxic SARS-CoV-2-reactive CD4+ T cells in COVID-19”。

这些研究人员将来自40名COVID-19患者的样本分为两组进行研究。住院组包括22名患者(其中9名在ICU治疗)。非住院组有18名患者,他们经历了较轻的COVID-19症状。他们利用单细胞RNA-seq分析了这些患者中对SARS-CoV-2有反应的CD4+ T细胞的类型。每种类型的T细胞都在对抗病毒中起着作用:一些T细胞(辅助性CD4+ T细胞)提醒身体注意感染,并招募其他免疫细胞,而另一些T细胞(滤泡辅助性T细胞,简称TFH细胞)则向B细胞发出信号以制造抗体。最后,还有一些T细胞(调节性T细胞,简称Treg细胞)发挥着抑制其他T细胞的作用,使得免疫系统不会破坏人体自身组织。Vijayanand说,“有多种不同类型的T细胞对这种病毒做出反应。”(生物谷 Bioon.com)

SARS-CoV-2(之前称为2019-nCoV)的透射电镜图,图片来自NIAID RML。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Cell期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Cell:从轻度新冠中恢复的人体可维持新冠病毒特异性的免疫记忆至少3个月
doi:10.1016/j.cell.2020.11.029
在一项新的研究中,来自美国华盛顿大学医学院等研究机构的研究人员对从轻度COVID-19中恢复的个体进行了纵向评估,以确定他们是否产生和维持多方位的SARS-CoV-2特异性免疫记忆。这些康复的个体产生了SARS-CoV-2特异性IgG抗体、中和血浆、记忆B细胞和记忆T细胞,并持续了至少三个月。相关研究结果于2020年11月23日在线发表在Cell期刊上,论文标题为“Functional SARS-CoV-2-specific immune memory persists after mild COVID-19”。
这些作者的数据进一步显示产生SARS-CoV-2特异性IgG的记忆B细胞随时间的增加而增加。此外,SARS-CoV-2特异性记忆淋巴细胞表现出与强效抗病毒功能相关的特征:记忆T细胞分泌细胞因子,并在抗原再次遇到时发生增殖,而记忆B细胞表达的受体当以单克隆抗体表达时能够中和病毒。
2.Cell论文详解在SARS-CoV-2感染和细胞因子休克综合征中,TNF-α和IFN-γ引发炎症细胞死亡、组织损伤和死亡机制
doi:10.1016/j.cell.2020.11.025
OVID-19大流行继续导致重大疾病和死亡,而治疗方案仍然有限。在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员发现了一种潜在的策略,可以防止COVID-19患者出现危及生命的炎症、肺部损伤和器官衰竭。相关研究结果于2020年11月18日在线发表在Cell期刊上,论文标题为“Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.11.025。
这些作者在发现与COVID-19相关的过度炎症免疫反应通过触发炎症细胞死亡途径导致小鼠组织损伤和多器官衰竭后,确定了候选药物。他们详细介绍了炎症细胞死亡信号通路如何发挥作用,从而有助于开发潜在的治疗方法来破坏这一过程。
论文通讯作者、圣犹大儿童研究医院免疫学系副主任Thirumala-Devi Kanneganti博士说,“了解驱动这种炎症的途径和机制对于开发有效的治疗策略至关重要。这项研究提供了这种理解。我们还确定了激活炎症细胞死亡途径的特异性细胞因子,在治疗COVID-19和包括败血症在内的其他高致命性疾病方面具有相当大的潜力。”
3.Cell:评估SARS-CoV-2刺突蛋白突变D614G对传播性和致病性的影响
doi:10.1016/j.cell.2020.11.020
在一项新的研究中,来自英国卡迪夫大学、 爱丁堡大学和帝国理工学院等研究机构的研究人员评估了1月至6月间在英国收集的2.5万多份SARS-CoV-2全基因组序列。与其他地方一样,614G在英国3月下旬成为主导的变体,这种614G变体经过多次独立引入,大多来自曾在国际上旅行的人。他们还证实,614G与感染严重程度无关,并观察到年轻患者更容易感染614G,且病毒载量更高。他们的结研究果支持这样的一个观点:614G是阳性选择,很可能影响这种病毒的传播性。相关研究结果于2020年11月18日在线发表在Cell期刊上,论文标题为“Evaluating the effects of SARS-CoV-2 Spike mutation D614G on transmissibility and pathogenicity”。
论文共同作者、英国卡迪夫大学遗传流行病学家Thomas Connor告诉《科学家》杂志,“即使有了这个庞大的数据集,我们几乎已经突破了识别这种影响存在的能力极限。”如果样本量较小,检测如此微小的传染性变化将更加困难。
4.Cell:我国科学家揭示新冠病毒复制转录复合体的低温电镜结构
doi:10.1016/j.cell.2020.11.016
SARS-CoV-2 mRNA的转录需要由复制转录复合体(replication and transcription complex, RTC)促进的一系列反应。
在一项新的研究中,来自中国清华大学、上海科技大学和武汉大学的研究人员展示了SARS-CoV-2 RTC向cap结构合成过渡时的结构快照。他们解析出由nsp7-nsp82-nsp12-nsp132-RNA和单个RNA结合蛋白(即nsp9)组装而成的扩展RTC在原子分辨率下的低温电镜结构。相关研究结果于2020年11月14日在线发表在Cell期刊上,论文标题为“Cryo-EM Structure of an Extended SARS-CoV-2 Replication and Transcription Complex Reveals an Intermediate State in Cap Synthesis”。
5.Cell:巴瑞替尼可降低新冠病毒感染的恒河猴中的炎症
doi:10.1016/j.cell.2020.11.007
SARS-CoV-2诱导的高细胞因子血症(hypercytokinemia)和炎症与COVID-19的疾病严重程度密切相关。作为一种临床批准的JAK1/2抑制剂,巴瑞替尼(baricitinib)目前正在COVID-19临床试验中进行研究。在一项新的研究中,来自美国埃默里大学的研究人员研究了巴瑞替尼在SARS-CoV-2感染的恒河猴模型中的免疫学和病毒学疗效。这种恒河猴模型模拟了在COVID-19患者中观察到的炎症特征。相关研究结果于2020年11月9日在线发表在Cell期刊上,论文标题为“Baricitinib treatment resolves lower airway macrophage inflammation and neutrophil recruitment in SARS-CoV-2-infected rhesus macaques”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.11.007。
从鼻腔拭子、咽喉拭子、支气管肺泡灌洗液和组织中测得的病毒脱落并没有因为使用巴瑞替尼而减少。不过,巴瑞替尼可抑制肺部巨噬细胞中促炎细胞因子的产生。I型IFN抗病毒反应和SARS-CoV-2特异性T细胞反应在两组接受巴瑞替尼治疗的恒河猴中保持相似。接受巴瑞替尼治疗的恒河猴显示炎症减少、肺部炎症细胞浸润减少、中性粒细胞捕获网(NETosis)活性降低,肺部病理更为有限。这表明在接受巴瑞替尼治疗的恒河猴中,这种药物保持了先天性抗病毒反应和SARS-CoV-2特异性T细胞反应。
6.Cell:详解一例神奇的病例!一名女性白血病患者感染新冠病毒后至少70天仍在脱落传染性病毒颗粒
doi:10.1016/j.cell.2020.10.049
大多数感染SARS-CoV-2冠状病毒的人似乎会在8天左右的时间里活跃地脱落传染性病毒,但人与人之间的差异性很大。了解人们能在多长时间内保持活跃感染是很重要的,这是因为它提供了关于一种仍然没有很好地理解的疾病和病毒的新细节,这有助指导公共卫生决策。在一项新的研究中,来自美国国家卫生院(NIH)、马歇尔大学和英国牛津大学等研究机构的研究人员报告了一个不寻常的案例:一名患有白血病和具有低抗体计数的女性感染这种冠状病毒至少105天,保持传染性至少70天,然而她在整个过程中一直没有症状。相关研究结果于2020年11月4日在线发表在Cell期刊上,论文标题为“Case Study: Prolonged infectious SARS-CoV-2 shedding from an asymptomatic immunocompromised cancer patient”。
论文共同通讯作者、美国国家过敏与传染病研究所(NIAID,为NIH的一个下属机构)病毒学家Vincent Munster说,“在我们开始这项研究的时候,我们对病毒脱落的持续时间确实了解不多。随着这种病毒的持续传播,更多患有一系列免疫抑制性疾病的人将会被感染,了解SARS-CoV-2在这些人群中的表现非常重要。”
7.Cell:揭示受损的功能性体液免疫反应与COVID-19死亡率密切相关
doi:10.1016/j.cell.2020.10.052
为了充分确定保护性体液免疫反应,来自美国拉根研究所、麻省理工学院、哈佛医学院和麻省总医院的研究人员在一项新的研究中剖析了193名患有中度到重度COVID-19的住院患者的体液免疫反应的早期演变。相关研究结果于2020年11月3日在线发表在Cell期刊上,论文标题为“Compromised humoral functional evolution tracks with SARS-CoV-2 mortality”。
尽管患有重度COVID-19的存活者(survivor)和非存活者(non-survivor)都进化出了强健的IgM和IgA反应,但非存活者表现出减弱的IgG反应,同时伴有受损的Fcɣ受体结合和Fc效应活性,这表明体液免疫反应发育不完善,不过他们并未产生增强疾病的体液免疫反应。相反,患有中度COVID-19的患者表现出延迟的体液免疫反应,但是所表现出的体液免疫反应最终会发育成熟。
8.Cell:令人关注!大约20%的新冠肺炎患者在三到四个月内维持抗病毒抗体产生
doi:10.1016/j.cell.2020.10.051
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。关于COVID-19的一个迫切问题依然存在:免疫力能持续多久?免疫力的一个关键指标是病毒特异性抗体的存在。关于从感染中康复的人是否能维持潜在的保护性抗体,以前的研究提供了相互矛盾的说法。
在一项新的研究中,来自美国布莱根妇女医院等研究机构的研究人员检查了来自从轻度到中度COVID-19中康复的患者的血液样本和细胞,发现虽然大多数患者在疾病消退后抵抗这种病毒的抗体下降,但是有一部分患者在感染后几个月内持续产生抗病毒抗体。这些抗体“维持者(sustainer)”的症状过程较短,这表明一些从COVID-19中恢复较快的患者可能对这种病毒产生了更有效和持久的免疫反应。相关研究结果于2020年11月3日在线发表在Cell期刊上,论文标题为“Quick COVID-19 Healers Sustain Anti-SARS-CoV-2 Antibody Production”。
9.Cell:揭示轻度和中度COVID-19疾病状态之间的急剧变化
doi:10.1016/j.cell.2020.10.037
在一项新的研究中,来自美国拉根研究所、麻省理工学院、哈佛医学院和麻省总医院的研究人员对139名不同疾病严重程度的COVID-19患者的临床测量结果、免疫细胞和血浆多组学(plasma multi-omics)数据进行了综合分析,这些患者是在确诊后的第一周期间接受连续采血。相关研究结果近期发表在Cell期刊上,论文标题为“Multi-omics resolves a sharp disease-state shift between mild and moderate COVID-19”。

新冠病毒(SARS-CoV-2)电子显微图,图片来自NIH。
这些研究人员鉴定出轻度COVID-19和中度COVID-19之间的一个主要转变,在这个转变点,炎症信号的升高伴随着特定类代谢物和代谢过程的丧失。在中度COVID-19患者的这种应激的血浆环境中,出现了多种不同寻常的免疫细胞表型,并这些表型随着疾病严重程度的增加而放大。他们将120000多种免疫特征浓缩成一个轴,以捕捉不同免疫细胞类型如何协调对SARS-CoV-2感染作出反应。这个免疫反应轴(immune-response axis)独立地与主要血浆成分变化、临床凝血指标以及从轻度COVID-19到中度COVID-19的急剧转变相一致。这项研究表明,中度COVID-19可能为治疗干预提供最有效的环境。
10.Cell:重大进展!包括新冠病毒在内的β冠状病毒利用溶酶体劫持和离开受感染细胞
doi:10.1016/j.cell.2020.10.039
在一项新的研究中,来自美国国家卫生研究院(NIH)的研究人员发现了一种生物途径,当包括SARS-CoV-2在内的β冠状病毒在体内传播时,它们似乎可以利用这种生物途径劫持和离开细胞。更好地了解这一重要途径可能会在阻止这种导致COVID-19疾病的SARS-CoV-2冠状病毒的传播方面提供了重要的新见解。相关研究结果于2020年10月27日在线发表在Cell期刊上,论文标题为“β-Coronaviruses use lysosomes for egress instead of the biosynthetic secretory pathway”。
在细胞研究中,这些作者首次发现,β冠状病毒可以通过溶酶体---一种称为细胞“垃圾粉碎机(trash compactor)”的细胞器---离开受感染的细胞。通常情况下,溶酶体会在病毒和其他病原体离开细胞之前将它们摧毁。然而,这些作者发现,β冠状病毒会使得溶酶体的抗病机制失活,从而允许它在体内自由传播。靶向这种溶酶体途径有可能导致人们开发新的、更有效的抗病毒疗法来对抗COVID-19。
11.Cell:通过CRISPR筛选鉴定出抵抗新冠病毒感染的基因和药物靶标
doi:10.1016/j.cell.2020.10.030
在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭示了人类基因组中的哪些基因和基因调控网络是SARS-CoV-2感染所需的,抑制这些基因赋予了对这种冠状病毒感染的抵抗力。他们描述了一系列以前没有被认为是SARS-CoV-2治疗靶点的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Identification of required host factors for SARS-CoV-2 infection in human cells”。
为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。
12.Cell:全基因组CRISPR筛选鉴定出对新冠病毒感染至关重要的宿主因子
doi:10.1016/j.cell.2020.10.028
在一项新的研究中,来自美国耶鲁大学和布罗德研究所等研究机构的研究人员对暴露于SARS-CoV-2和MERS-CoV冠状病毒的数亿个细胞进行了筛选,鉴定出几十个能使这两种病毒在细胞中复制的基因,也鉴定出一些似乎抑制这些病毒的基因。他们表示,这些基因的促病毒作用和抗病毒作用将有助于指导科学家们开发新的疗法来对抗COVID-19。相关研究结果近期发表在Cell期刊上,论文标题为“Genome-wide CRISPR screens reveal host factors critical for SARS-CoV-2 infection”。

图片来自NIH。
在这项新的研究中,这些研究人员对绿猴细胞进行了全基因组CRISPR筛选,其中与常用的人类细胞系相比,绿猴细胞在暴露于SARS-CoV-2后更容易死亡。这种筛选首次允许他们同时跟踪病毒和细胞之间的相互作用。这种筛选证实了早先的发现,即编码细胞表面受体的ACE-2基因能促进SARS-CoV-2感染宿主细胞。
然而,这种筛选还发现了两种新的促病毒蛋白复合物和第三种似乎有助于阻止感染的蛋白复合物。他们发现,能开启和关闭基因的SWI/SNF复合物和具有包括调节炎症在内的许多功能的HMGB1与感染后细胞死亡增加有关。
这些研究人员随后加入了抑制已发现的这两种基因产物功能的小分子药物,并发现它们可以增加培养皿中的细胞在感染后的存活率。相比之下,有助于调节细胞核内基因表达的组蛋白H3复合物似乎提供了一种保护作用,这会抑制SARS-CoV-2感染和杀死细胞的能力。
13.Cell:感染新冠病毒的人类和恒河猴肺部组织出现内皮破坏和血管血栓形成
doi:10.1016/j.cell.2020.10.005
在一项新的研究中,来自美国贝斯以色列女执事医疗中心和拉根研究所等研究机构的研究人员证实了来自感染SARS-CoV-2的人类和恒河猴的肺部组织病理切片中出现内皮破坏和血管血栓形成。相关研究结果近期发表在Cell期刊上,论文标题为“Vascular Disease and Thrombosis in SARS-CoV-2-Infected Rhesus Macaques”。
为了确定与SARS-CoV-2在恒河猴中发病相关的关键分子途径,这些研究人员对支气管肺泡灌洗液和外周血进行了转录组分析,并对血清进行了蛋白质组分析。他们观察到肺部有巨噬细胞浸润,巨噬细胞、补体、血小板活化、血栓形成和促炎症标志物上调,包括C反应蛋白、MX1、IL-6、IL-1、IL-8、TNFα和NF-κB。
14.Cell:揭示新冠病毒破坏人体细胞的剪接、翻译和蛋白运输,从而抑制人体抗病毒防御
doi:10.1016/j.cell.2020.10.004
如今,在一项新的研究中,来自美国加州理工学院和佛蒙特大学等研究机构的研究人员确定了SARS-CoV-2病毒让人体细胞丧失能力的机制:这基本上使得人体细胞的报警系统失效,从而无法呼救附近细胞的帮助,也无法提醒附近细胞存在感染。了解这种病毒如何导致细胞水平上的功能障碍,为如何对抗它提供了新的见解。相关研究结果于2020年10月8日在线发表在Cell期刊上,论文标题为“SARS-CoV-2 disrupts splicing, translation, and protein trafficking to suppress host defenses”。论文通讯作者为加州理工学院生物学教授Mitchell Guttman博士和佛蒙特大学医学院研究员Devdoot Majumdar博士。
SARS-CoV-2病毒会产生大约30种病毒蛋白。在这项新的研究中,Guttman实验室检查了其中的每一种,并绘制了它们如何与实验室培养皿中培养的人体细胞内的分子成分相互作用。他们发现SARS-CoV-2蛋白会攻击三个关键的细胞过程,以破坏人类蛋白的产生。
论文共同第一作者、佛蒙特大学的Emily Bruce说,“病毒太了不起了。病毒和宿主细胞不断进行进化军备竞赛,以战胜对方。SARS-CoV-2已进化出复杂而特殊的方法来使宿主细胞丧失功能,而不会直接杀死它们,这样这种病毒仍然可以利用宿主细胞达到它自己的目的。”
15.Cell:首次详细概述人体CD4+ T细胞对新冠病毒的反应
doi:10.1016/j.cell.2020.10.001
随着世界各地的科学家们开发出拯救生命的COVID-19疫苗和药物,许多人仍然想知道究竟为什么这种疾病在一些人身上是致命的,而在另一些人身上是轻微的。为了解决这个难题,科学家们需要深入了解人体多种类型的免疫细胞如何应对SARS-CoV-2,即导致COVID-19疾病的冠状病毒。
在一项新的研究中,来自美国拉霍亚免疫学研究所、英国利物浦大学和南安普顿大学等研究机构的研究人员首次详细概述了人体的CD4+ T细胞如何应对SARS-CoV-2病毒。除此之外,他们的研究还表明,在患病早期,住院的重症COVID-19患者会产生一种有可能杀死B细胞和减少抗体产生的新型T细胞亚群。这些发现为进一步的详细分析提供了重要的基础,并展示了一种称为单细胞RNA测序(RNA-seq)的前沿技术的力量。相关研究结果于2020年10月5日在线发表在Cell期刊上,论文标题为“Imbalance of regulatory and cytotoxic SARS-CoV-2-reactive CD4+ T cells in COVID-19”。

扫描电镜图显示SARS-CoV-2(蓝色的圆形物体)从实验室培养的细胞表面上显现出来,图片来自NIAID。
这些研究人员将来自40名COVID-19患者的样本分为两组进行研究。住院组包括22名患者(其中9名在ICU治疗)。非住院组有18名患者,他们经历了较轻的COVID-19症状。他们利用单细胞RNA-seq分析了这些患者中对SARS-CoV-2有反应的CD4+ T细胞的类型。每种类型的T细胞都在对抗病毒中起着作用:一些T细胞(辅助性CD4+ T细胞)提醒身体注意感染,并招募其他免疫细胞,而另一些T细胞(滤泡辅助性T细胞,简称TFH细胞)则向B细胞发出信号以制造抗体。最后,还有一些T细胞(调节性T细胞,简称Treg细胞)发挥着抑制其他T细胞的作用,使得免疫系统不会破坏人体自身组织。Vijayanand说,“有多种不同类型的T细胞对这种病毒做出反应。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


