骨髓瘤新药!赛诺菲CD38靶向抗体Sarclisa+RVd方案:在符合移植条件的新诊患者中实现高MRD阴性率!
来源:本站原创 2021-12-25 00:40
GMMG-HD7试验是第一个在符合移植条件的新诊MM患者中达到MRD阴性主要终点的3期研究。
多发性骨髓瘤(图片来源:dxline.info)
2021年12月24日讯 /生物谷BIOON/ --赛诺菲(Sanofi)近日公布了关键3期GMMG-HD7试验的结果。该试验在新诊断的、符合移植资格的多发性骨髓瘤(MM)患者中开展。结果显示,该研究达到了主要终点:与接受标准护理方案来那度胺+硼替佐米+地塞米松(RVd)的患者相比,接受CD38靶向抗体Sarclisa(isatuximab)+RVd方案治疗的患者在诱导治疗(18周)结束后、移植前的微小残留病(MRD)阴性率有统计学上的显著改善,50.1%的患者达到无法检测到的疾病水平,而RVd对照组为35.6%。MRD阴性是与更好患者预后相关的重要临床终点。
值得一提的是,GMMG-HD7试验是第一个在符合移植条件的新诊MM患者中达到MRD阴性的3期研究。同时,Sarclisa+RVd是第一个在3期临床试验中疗效优于标准护理(RVd)的方案。MRD阴性被定义为治疗后骨髓中没有骨髓瘤细胞,通过诊断技术测量,其灵敏度必须至少为1/100000。该评估是测量MM患者治疗缓解深度的最敏感工具。
GMMG-HD7试验的首席研究员、GMMG总裁、德国海德堡大学医院(UKHD)医学教授Hartmut Goldschmidt表示:“在这种方案治疗的早期,半数患者出现MRD阴性是前所未有的。我们知道,在治疗早期获得更深层次的缓解可能转化为更长的无进展生存期(PFS),我们对这些结果感到兴奋。”
赛诺菲肿瘤学全球开发负责人Peter C.Adamson表示:“这项试验的结果强化了我们对Sarclisa成为抗CD38首选药物潜力的信念。在相对较短的诱导期后观察到如此高比例的MRD阴性患者非常令人鼓舞。我们期待着与GMMG继续合作,为新诊断的多发性骨髓瘤患者提供潜在的治疗选择。”
GMMG-HD7试验由德语骨髓瘤多中心组 (GMMG)发起、并与赛诺菲密切合作开展,这是一项随机、开放标签、多中心、两部分3期试验,在德国67个临床中心入组了662例新诊断的、符合移植条件的MM患者。在研究的第一部分中,所有患者被平均随机分配至2个治疗组,均接受3个周期(42天一个周期)RVd治疗,其中一组还接受Sarclisa治疗。Sarclisa给药方案为:在第一个周期的前4周,通过静脉输注10mg/kg剂量、每周一次,然后在诱导期的剩余时间每隔一周给药一次。诱导后通过下一代流式细胞术(截断值[cut-off]为1x10E-5)评估MRD阴性,并使用优势比来衡量这一终点,以确定将Sarclisa添加到标准护理和患者实现MRD阴性之间的关联。
主要终点是研究第一部分诱导治疗后的MRD阴性率,以及研究第二部分移植后第二次随机分组后的无进展生存期(PFS),其中Sarclisa加入来那度胺维持治疗。次要终点包括诱导后的完全缓解率(CR)、维持治疗后的总生存期(OS)和安全性。
结果显示,在18周诱导期(3x42天)后,接受Sarclisa联合治疗的患者组(n=331)MRD阴性率为50.1%,而接受RVd的患者组(n=329)MRD阴性率为35.6%(比值比[OR]=1.83;95%CI:1.34-2.51;p<0.001)。该研究中观察到的Sarclisa的安全性和耐受性与其他临床试验中观察到的Sarclisa的安全性特征一致,未观察到新的安全性信号。观察到的所有不良事件发生率,Sarclisa联合治疗组为63.6%,RVd治疗组为61.3%,2个研究组的严重不良反应和停药率相似(分别为34.8%和36.3%)。然而,在诱导期,RVd组的死亡人数较高(1.2% vs 2.4%)。在第二次随机分组后,该试验正在进行中,以评估Sarclisa+来那度胺作为维持治疗的无进展生存期(PFS)。
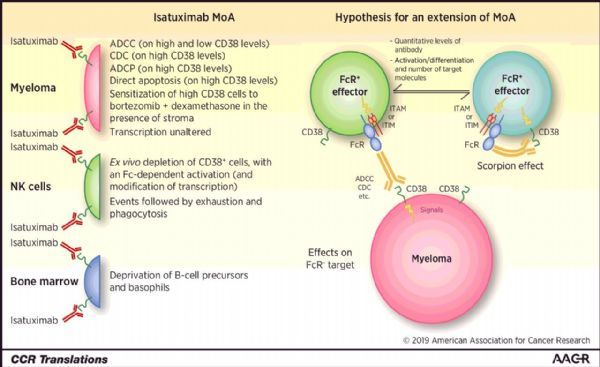
Sarclisa作用机制(图片来源:aacrjournals.org)
Sarclisa的活性药物成分isatuximab是一种IgG1嵌合单克隆抗体,靶向浆细胞CD38受体的特定表位,能够触发多种独特的作用机制,包括促进程序性肿瘤细胞死亡(凋亡)和免疫调节活性。CD38在多发性骨髓瘤(MM)细胞上呈高水平表达,是MM和其他恶性肿瘤中抗体治疗的细胞表面受体靶标。在美国和欧盟,isatuximab均被授予了治疗复发或难治性多发性骨髓瘤(R/R MM)的孤儿药资格。目前,赛诺菲也正在评估isatuximab治疗其他血液系统恶性肿瘤和实体瘤的潜力。
2020年3月,Sarclisa获得美国FDA批准,联合泊马度胺和地塞米松(pom-dex),用于既往已接受过至少2种疗法(包括来那度胺和蛋白酶体抑制剂)的RRMM成人患者。2020年6月初,Sarclisa联合pom-dex方案也获得了欧盟委员会(EC)的批准。
Sarclisa是强生重磅CD38靶向药物Darzalex的第一个直接竞争对手,后者于2015年上市,适应症涵盖1-4线用药,已成为临床基石疗法,2020年全球销售额达到41.9亿美元,较上一年增幅达39.8%。华尔街投资银行Jefferies分析师预计,Sarclisa上市后的年销售峰值将突破10亿美元。
当前,赛诺菲正在推进多项III期临床研究,评估isatuximab联合目前可用的标准疗法,用于治疗RRMM患者或新诊断的MM患者。MM是第二种最常见的血液系统恶性肿瘤,在全球范围内,每年患病人数超过138万。对于大多数患者而言,MM仍然无法治愈,因此该领域存在着显著的未满足医疗需求。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->