多篇重要成果解读中和性抗体疗法研究新进展!
来源:生物谷原创 2022-04-29 15:06
本文中,小编整理了近期科学家们发表的多篇重要研究成果,共同解读中和性抗体疗法研究新进展,分享给大家!
本文中,小编整理了近期科学家们发表的多篇重要研究成果,共同解读中和性抗体疗法研究新进展,分享给大家!

图片来源:Science, 2022, doi:10.1126/science.abn7760。
【1】Science:揭示一些中和抗体仍可有效中和包括奥密克戎在内的新冠病毒变体
doi:10.1126/science.abn8897
作为令人关注的SARS-CoV-2变体,B.1.1.529(Omicron,奥密克戎)的出现和快速传播引起了人们的警惕。特别麻烦的是Omicron受体结合结构域(RBD)中的15个氨基酸替换,因为靶向RBD的抗体(即RBD靶向抗体)是唯一被发现对其他变体保持足够效力的抗体。为了确定能有效中和Omicron的抗体,来自美国国家过敏与传染病研究所的研究人员在一项新的研究中评估了RBD靶向抗体结合和中和Omicron的能力,并利用功能试验和低温电镜(cryo-EM)结构确定了它们的识别模式。相关研究结果发表在2022年4月22的Science期刊上,论文标题为“Structural basis for potent antibody neutralization of SARS-CoV-2 variants including B.1.1.529”。
令人关注的Omicron变体对大多数单克隆抗体以及疫苗接种者和康复者血清的中和有很大的抵抗力。识别对这种变体保持中和效力的单克隆抗体,并了解它们识别的结构机制,应有助于开发保持有效性的疫苗和抗体治疗剂。
Omicron刺突蛋白位于它的融合前构象下的低温电镜结构显示了单个RBD向上构象,RBD替换突变定位在刺突蛋白的外表面。尽管有这种定位,但RBD替换突变直接位于或相邻于所有先前确定的RBD靶向中和抗体的表位。这项新的研究显示,抗体A23-58.1、B1-182.1、COV2-2196、S2E12、A19-46.1、S309和LY-CoV1404仍然对这种新出现的变体保持了大量的中和作用。为了提供结构和功能上的解释,这些作者确定了抗体-刺突蛋白复合物的低温电镜结构,并使用代表15个RBD氨基酸替换中每个的病毒颗粒来描述其功能影响。
【2】Science子刊:发现广泛中和汉坦病毒的人类单克隆抗体
doi:10.1126/scitranslmed.abl5399
在一项新的研究中,来自美国、芬兰、瑞典、德国和法国的研究人员发现首个能在动物模型中有效中和两种汉坦病毒(hantavirus)的人类抗体。根据他们的初步结果,这种抗体似乎是开发“泛汉坦病毒(pan-hantavirus)”疗法的一个有希望的候选者,以防止由多种已知或新出现的汉坦病毒引起的疫情爆发。相关研究结果发表在2022年3月16日的Science Translational Medicine期刊上,论文标题为“Human antibody recognizing a quaternary epitope in the Puumala virus glycoprotein provides broad protection against orthohantaviruses”。
汉坦病毒每年在全球范围内共造成约50000例严重且往往是致命的感染。虽然人类通常是通过与啮齿动物的接触而感染,但是这些病毒也可以通过人与人的直接接触来传播。目前还没有批准的治疗汉坦病毒感染的疗法。啮齿动物传播的汉坦病毒分为两个不同的病毒家族,通常称为“旧世界”和“新世界”汉坦病毒,并引起两种类型的疾病。肾综合征出血热(hemorrhagic fever with renal syndrome, HFRS)是由主要在欧洲和亚洲发现的旧世界汉坦病毒引起的,而新世界汉坦病毒引起汉坦病毒心肺综合征(hantavirus cardiopulmonary syndrome, HCPS),通常在北美洲和南美洲发现。
在这篇论文中,这些作者描述了从瑞典一名感染了普马拉病毒(Puumala virus)的患者身上分离出的几种人类单克隆抗体(mAb)。作为一种旧世界汉坦病毒,普马拉病毒在人类中引起HFRS。通过在体外培养的细胞中进行初步筛选,他们确定了几种能有效中和旧世界和新世界汉坦病毒的mAb。
【3】Nat Med:1期临床试验表明广泛中和抗体PGT121可长期抑制患者体内的HIV感染
doi:10.1038/s41591-021-01509-0
自首次公布关于获得性免疫缺乏综合征(AIDS,俗称艾滋病)的报告以来的40年中,超过3200万人死于导致艾滋病的病毒---人类免疫缺陷病毒(HIV)。如今,鉴于全世界有超过3500万HIV感染者,每年有近200万新病例,HIV仍然是一种主要的全球流行病。
广泛中和抗体(bNAB)靶向这种病毒外部的特定蛋白。在一项1期临床试验中,来自美国贝斯以色列女执事医疗中心(BIDMC)等研究机构的研究人员评估了一种称为PGT121的广泛中和抗体治疗和预防HIV-1感染的能力。他们发现,该抗体是安全的,试验参与者耐受性良好,并且它在感染HIV的成年人中也表现出抗病毒活性。相关研究结果发表在2021年10月的Nature Medicine期刊上,论文标题为“Safety, pharmacokinetics and antiviral activity of PGT121, a broadly neutralizing monoclonal antibody against HIV-1: a randomized, placebo-controlled, phase 1 clinical trial”。
在这项纳入感染和未感染HIV的成年人以及正在接受抗逆转录病毒疗法(ART)以抑制HIV感染的成年人的安慰剂对照临床试验中确定了该抗体的安全性和耐受性之后,这些作者接下来在未接受ART治疗因而携带可检测的病毒载量的HIV成年人中评估了该抗体。在参与这项临床试验这一部分的13名参与者中,有9人被发现在基线时具有高病毒载量(每毫升血液超过2000个病毒拷贝),4人被发现在基线时具有低病毒载量(每毫升血液少于2000个拷贝)。
【4】Science:揭示茎螺旋特异性人类抗体可广泛中和多种β冠状病毒,从而有可能开发泛冠状病毒疫苗
doi:10.1126/science.abj3321
在过去的20年里,三种流行性或大流行性冠状病毒---SARS-CoV、MERS-CoV和SARS-CoV-2---已经从动物身上溢出,导致人类的致命疾病。研究病毒的科学家们决心发现一种方法来广泛保护人们免受新出现的冠状病毒的持续威胁。创造这种全面对策的线索可能来自于一类罕见的人类抗体,它可以中和几种不同的冠状病毒。这些抗体已经在一些从COVID-19中康复的人身上检测出来。在一项新的研究中,来自瑞士、美国、比利时、澳大利亚和意大利的研究人员描述了对五种这样的人类单克隆抗体的研究,这些抗体可以与多种β冠状病毒发生交叉反应。这些抗体靶向结合这些β冠状病毒的刺突蛋白中的一种称为称为茎螺旋(stem helix)的结构。刺突蛋白对于β冠状病毒攻克宿主细胞的防御能力至关重要。相关研究结果于2021年8月3日在线发表在Science期刊上,论文标题为“Broad betacoronavirus neutralization by a stem helix–specific human antibody”。
在某些冠状病毒的进化过程中,刺突蛋白中的茎螺旋一直保持保守。这意味着它更不容易发生遗传变化,而且在各种冠状病毒中都是相似的。这些冠状病毒包括那些起源于蝙蝠并已成为人体内危险病原体的冠状病毒,以及另一个引起由单峰骆驼传播的严重人类肺部疾病的冠状病毒亚属,以及其他一些引起普通感冒症状的冠状病毒亚属。
这些作者在他们的论文中解释说,他们对探索靶向使冠状病毒与宿主细胞膜融合的刺突蛋白的高度保守区域的抗体感兴趣。刺突蛋白的其他部分与宿主细胞的受体初步接触,并且在身体抗体反应的选择压力下有迅速变异和形成变体的趋势。抗体与刺突蛋白中变异性较小的融合区域结合的能力是使其能够中和亲缘关系较远的冠状病毒的原因。
为了找到这类抗体,这些作者检查了COVID-19康复期捐赠者的某些记忆B细胞。记忆B细胞是一种白细胞,能识别并应对在以前的遭遇中试图攻击身体的病原体。在他们分离出的五种有希望的抗体中,他们决定集中研究一种名为S2P6的抗体。分子结构分析和功能研究显示,这种人类单克隆抗体具有令人印象深刻的中和广度:它能够中和β冠状病毒的三种不同亚属。他们观察到,它是通过抑制β冠状病毒与细胞膜融合的能力来做到这一点。
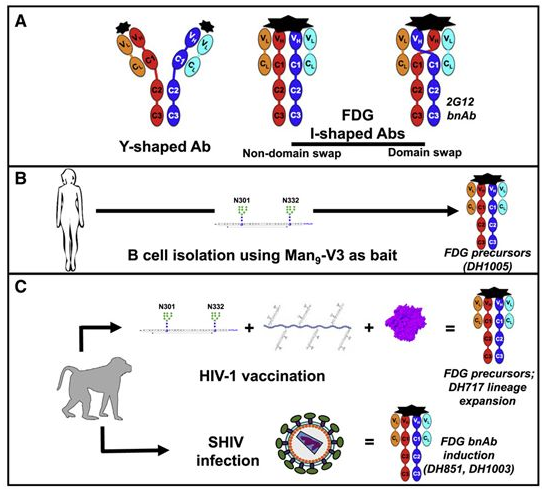
图片来源:Cell, 2021, doi:10.1016/j.cell.2021.04.042。
doi:10.1016/j.cell.2021.04.042
天然抗体可以靶向病原体表面上的宿主聚糖。在一项新的研究中,来自美国杜克大学人类疫苗研究所的研究人员报告,一组新发现的与HIV病毒外壳上的聚糖结合的抗体能够有效地中和这种病毒,并指出一种新的疫苗方法也可潜在地用于对抗SARS-CoV-2和真菌病原体。相关研究结果于2021年5月20日在线发表在Cell期刊上,论文标题为“Fab-dimerized glycan-reactive antibodies are a structural category of natural antibodies”。
这些作者描述了在猴子和人类中发现的一类免疫细胞,它们产生一种独特的抗聚糖抗体(anti-glycan antibody)。这种新描述的抗体有能力附着在HIV外层的聚糖斑(a patch of glycans)上。这些聚糖斑是链状糖结构,类似于存在于宿主细胞表面上的聚糖。这代表了一种新的宿主防御形式。这些新发现的抗体具有一种特殊的形状,可能对各种病原体有效。这些作者是在一系列探索是否存在靶向覆盖HIV外表面的聚糖的免疫反应中发现了这种抗体。
HIV的外层有50%以上是由聚糖组成的。长期以来,释放抗聚糖抗体来分解这些糖结构,触发B细胞产生中和这种病毒的抗体,一直是一种诱人的方法。相反,HIV被披上了看起来像宿主聚糖的糖衣,形成了一种盾牌,使这种病毒看起来是宿主的一部分,而不是一个致命的病原体。
【6】Nature:科学家发现抗HIV-1抗体治疗可抑制病毒感染
doi:10.1038/s41586-022-04597-1
HIV-1感染仍然是一个无法治愈的公共卫生问题。抗逆转录病毒疗法(ART)在抑制病毒复制和预防疾病进展方面非常有效,但由于潜伏前病毒库稳定地整合到CD4 T细胞基因组中,因此需要终身药物管理。在没有抗逆转录病毒治疗的情况下,向人类施用抗HIV-1广泛中和抗体(bNAbs)是安全的,并且能够有效地预防感染,降低病毒血症和维持抗体敏感病毒的病毒抑制。有人提出,广泛中和抗体可以作为ART的辅助药物,或作为旨在诱导长期无ARTHIV-1缓解的独立维持治疗。近日,洛克菲勒大学的研究学者们在Nature上发表了一篇题为“Prolonged viral suppression with anti-HIV-1 antibody therapy”的学术论文,评估了重复bNAb联合治疗维持长期病毒抑制的有效性及其对HIV感染者潜伏病毒库的大小和组成的影响。
在本研究中,研究人员进行了一项临床研究,其中HIV感染者在存在或不存在ART的情况下,在20周内接受了七剂两种广泛中和抗体3BNC117和10-1074的组合,对其安全性、耐受性和抗病毒活性进行了研究。
研究发现,3BNC117和10-1074的药代动力学特征在病毒抑制期间与同时存在的抗逆转录病毒药物无关,并且在20周内多次给药后不会改变。在没有预先筛查抗体敏感性的情况下,17名(76%)可评估的1组受试者中有13名在ART停用后至少20周内保持病毒抑制。在第20周后仍然受到抑制的个体中,反弹时3BNC117和10-1074的平均血清浓度分别为3.5和28.3μg·ml?1。为了检查病毒单克隆抗体敏感性测试对病毒反弹时间的潜在影响,研究人员对储库和血浆反弹病毒进行了事后分析。研究发现,事后敏感性分析并不能预测病毒反弹的时间。在病毒被抑制20周以上的个体中,当其中一种抗体的血清浓度达到10μg·ml?1以下时,会出现反弹的病毒血症。在接受所有七个抗体剂量的人中,有两个人在一年后保持了抑制。抗体治疗6个月后进行的储库分析显示完整的前病毒储库的大小和组成发生了变化。相比之下,这些人的缺陷库没有明显的减少。
【7】Nat Commun:广泛中和抗HIV抗体将病毒颗粒固定在受感染细胞的表面
doi:10.1038/s41467-022-28307-7
在一项新的研究中,来自法国国家科学研究中心(CNRS)、巴斯德研究所、疫苗研究所 (VRI) 和巴黎大学的研究人员通过将前沿显微镜技术应用于体外病毒培养,发现了抗HIV-1抗体的新功能。他们发现,某些已知能有效靶向 HIV-1 包膜 (Env) 蛋白的抗体可以阻止受感染的细胞释放病毒颗粒,从而阻止病毒传播。这些抗体呈Y形,使它们能够将自身附着在受感染细胞和病毒颗粒之间或直接附着在病毒颗粒之间。这条由抗体和病毒颗粒组成的链可以阻止病毒传播。这些发现表明这些强大的抗体除了中和作用外还表现出不同的抗病毒活性。相关研究结果于2022 年2月2日发表在 Nature Communications 期刊上,论文标题为“Broadly neutralizing anti-HIV-1 antibodies tether viral particles at the surface of infected cells”。
针对HIVEnv蛋白的广泛中和抗体 (bNAb) 具有治疗 HIV-1 的巨大潜力。它们最初是在血清能够抑制多种 HIV 毒株的罕见患者中发现的。这些抗体表现出多种抗病毒活性。除了中和这种病毒,即阻止它感染新细胞外,它们还杀死受感染的细胞。因此,它们被称为多功能分子。有必要充分了解这些抗病毒活性的范围,以便更有效地使用现有抗体或优化新抗体的选择标准。此外,进一步研究抗 HIV-1 抗体的多功能性有助于我们更好地理解抗体所起的作用,从而应对其他病毒感染。
【8】Science:新研究表明mRNA-1273疫苗加强注射会增加猴子的中和抗体反应和保护作用
doi:10.1126/science.abl8912
在一项新的研究中,来自美国国家卫生研究院等研究机构的研究人员在恒河猴接种初始疫苗系列(primary vaccine series)大约六个月后,给它们加强注射mRNA-1273 COVID-19疫苗,可显著提高针对所有已知SARS-CoV-2变体的中和抗体水平。相关研究结果于2021年10月21日在线发表在Science期刊上,论文标题为“Protection against SARS-CoV-2 beta variant in mRNA-1273 vaccine–boosted nonhuman primates”。
这项研究还表明,增加的中和抗体反应在加强疫苗注射后至少持续了8周,明显高于接种初始疫苗系列之后,并产生了高水平的保护---这意味着能够显著限制SARS-CoV-2在肺部和鼻子中的复制。这些数据表明,加强疫苗注射会引发强烈的免疫记忆反应,并有可能产生更持久的免疫力。
这些作者还确定,为针对原始SARS-CoV-2病毒而开发的mRNA-1273疫苗和针对这种病毒的Beta变体的稍加修改的疫苗在提高抗体反应和保护的能力方面是相当的。

广泛中和抗体(bNAb)和抗整合素α4β7抗体的组合使用比单独的bNAb更能减少B细胞滤泡聚集(棕色斑点)
图片来源:Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abf7201。
【9】Science子刊:α4β7整合素阻断有望延长广泛中和抗体对HIV的病毒学控制
doi:10.1126/scitranslmed.abf7201
40多年来,一种经常被证明是难以实现的目标是通过药物战胜人类免疫缺陷病毒(HIV)。近年来的重点是强调将更新、更隐蔽的武器带入这场战斗。虽然科学家们不断地接近于给这种病毒以击倒性的一击,但他们仍然不够接近于将HIV击倒在地。突破性的疫苗技术---mRNA免疫---在创纪录的时间内被开发出来,以对抗在全球蔓延的COVID-19大流行病。但是,针对HIV的mRNA免疫接种现在才刚刚开始研究。美国生物技术公司Moderna公司生产了一种解决SARS-CoV-2的mRNA疫苗,该公司正在进行预防HIV感染的mRNA疫苗的早期研究。
但是,还有其他一些方法也在酝酿之中,一些科学家说,这些方法可能会给一种自20世纪80年代初以来一直处于全球大流行病中心的HIV病毒以致命一击。
在一项新的研究中,来自美国多家研究机构的研究人员启动了一系列动物研究,通过使用多方面的抗体军队来处理HIV感染。其中的一些抗体是中和抗体,作为单克隆抗体给试验动物使用。另一种被设计成具有不同任务的单克隆抗体发挥阻断的作用,阻止HIV感染过程中的一种关键因子继续发挥它的促进病毒复制的作用。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Blocking α4β7 integrin delays viral rebound in SHIVSF162P3-infected macaques treated with anti-HIV broadly neutralizing antibodies”。
洛克菲勒大学人口理事会生物医学研究中心的Ines Frank博士是这项探究这种单克隆抗体方法的研究的第一作者。Frank及其同事们开发的这种治疗方法在一种大型动物模型中延迟了HIV样病毒(HIV-like virus)---猿-人类免疫缺陷病毒(simian-human immunodeficiency virus, SHIV)---的反弹。他们研究了这些抗体对SHIV的影响。
通过使广泛中和抗体(bNAb)以及另一种针对某些细胞受体的抗体类型,这些作者发现有可能将SHIV在受感染动物体内的反弹时间推迟数周。对于一些试验动物来说,这种抗体组合所带来的一击,可以无限期地击退SHIV,这一发现为治愈HIV感染奠定了基础。
【10】Cell: SARS-CoV-2突变株的潜在威胁以及广谱中和抗体的开发策略
doi:10.1016/j.cell.2021.03.055
要想尽快结束新冠疫情,全球范围内的疫苗接种,似乎是不可避免的手段。目前的COVID-19疫苗通过诱导机体产生靶向SARS-CoV-2刺突蛋白的中和抗体,从而起到保护作用。然而,由于新毒株的出现(例如起源于英国的B.1.1.7, 巴西的P.1以及南非的B.1.351毒株)以及其刺突蛋白的变异,现有疫苗的有效性可能会受到影响。在最近发表于Cell杂志的一项研究中,来自英国牛津大学的Gavin Screaton教授团队针对上述突变株以及中和抗体的亲和活性进行了详尽的分析,试图寻找更为有效的,针对上述突变毒株的中和抗体克隆,从而助力疫情的稳定与消除。
此前研究表明,B.1.1.7毒株, P.1毒株以及B.1.351毒株其刺突蛋白均存在不同程度的突变,其中P.1 具有三个突变位点:K417T, E484K 以及N501Y,B.1.351具有三个突变位点:K417N, E484K 以及N501Y,B.1.1.7具有一个单独的突变位点: N501Y。 上述突变均能够影响其与ACE2受体的亲和能力以及进而影响病毒的传播速率。此外,上述突变还会影响自然产生或疫苗接种后诱导产生的抗体对变异毒株的中和能力。
在前期研究中,作者首先通过咽拭子的手段从巴西境内的一名患者中采集到了P.1.毒株,并且将其与已有的B.1.1.7,B.1. 351毒株与血清的中和效果进行了比较。上述血清分别来自于早期SARS-CoV-2感染后患者以及经接种牛津-阿斯利康疫苗或辉瑞疫苗后的受体。结果显示,血清对P.1以及B.1.1.7毒株的中和能力均有一定程度下降,但并不明显;然而,血清对B.1. 351毒株的中和能力则出现的大幅下降。此前研究同时表明,P.1毒株的刺突蛋白RBD与宿主ACE2的亲和能力相比早期毒株有明显提升。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


