近期基因编辑研究领域重磅级文章解读!
来源:本站原创 2020-07-27 23:31
本文中,小编整理了近期科学家们在基因编辑研究领域取得的重磅级研究成果,与大家一起学习!图片来源:CC0 Public Domain【1】Neuron:基因编辑帮助神经元延长寿命doi:10.1016/j.neuron.2020.06.036大多数神经元是在胚胎发育过程中产生的,出生后没有“备份”。研究人员普遍认为,它们的存活率几乎是外在地决定的,或者是由外部
本文中,小编整理了近期科学家们在基因编辑研究领域取得的重磅级研究成果,与大家一起学习!

图片来源:CC0 Public Domain
doi:10.1016/j.neuron.2020.06.036
大多数神经元是在胚胎发育过程中产生的,出生后没有“备份”。研究人员普遍认为,它们的存活率几乎是外在地决定的,或者是由外部力(例如神经元向神经细胞提供的组织和细胞)决定的。由加利福尼亚大学河滨分校的生物医学科学家Sika Zheng领导的研究小组对这一概念提出了挑战,并报告了神经元的持续存活在发育过程中也是固有编程的。
这项发表在Neuron杂志上的研究发现了一种机制,研究人员说,这种机制是在神经元刚产生时触发的,从而固有地减少了一般形式的细胞死亡或“凋亡”的发生。当这种遗传调节停止时,连续的神经元存活被破坏并导致动物死亡。生物体的存活,脑功能和适应性取决于其神经元的存活。在高等生物中,神经元控制着呼吸,进食,感觉,运动,记忆,情感和认知。它们可能死于许多非自然原因,例如神经退行性疾病,伤害,感染和创伤。神经元是长寿的细胞,但使它们长寿的遗传控制尚不清楚。
【2】Nat Biotechnol:新型DNA碱基编辑器扩大精准基因组编辑的应用领域
doi:10.1038/s41587-020-0609-x
在一项新的研究中,来自美国麻省总医院和哈佛医学院的研究人员开发出的新型基因组编辑技术有潜力有助于理解基于C→G(由胞嘧啶突变为鸟嘌呤)单碱基变化的疾病相关基因突变。这些新的碱基编辑器也可最大限度地减少可能导致不良副作用的非预期(“脱靶”)突变。相关研究结果发表在Nature Biotechnology期刊上。
这些由CRISPR引导的新型DNA碱基编辑技术旨在高效地诱导DNA碱基的颠换(transversion,即一个嘌呤碱基被另一个嘧啶碱基替换,或者一个嘧啶碱基被另一个嘌呤碱基置换),同时将不需要的“旁观者”突变水平降至最低。在这篇论文中,这些作者描述了一种概念验证的称为CGBE1的C→G碱基编辑器,以及它的一个较小版本:miniCGBE1。CRISPR(clustered regularly interspaced short palindromic repeats, 规律间隔性成簇短回文重复序列)是一种基因编辑技术,最早是作为细菌中的一种防御机制被发现的,随后科学家们将它用作一种切除和/或修复DNA序列的工具。最早的CRISPR技术依赖于创建和修复双链DNA断裂。
【3】Science:重大突破!科学家开发出一种超快速的CRISPR-Cas9基因编辑技术 能在几秒钟内实现精准基因编辑!
doi:10.1126/science.aay8204
近日,一项刊登在国际杂志Science上的研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究利用光敏核苷酸开发了一种新方法来加速CRISPR-Cas9基因编辑的过程,文章中,研究者描述了整个实验过程及其这种新方法的精准性;在Science杂志同一期的一篇展望文章中,来自纪念斯隆凯特琳癌症中心的科学家们还概述了CRISPR-Cas9基因编辑技术的进化历程。
在CRISPR-Cas9基因编辑过程中,酶类Cas9能被用作剪刀在基因编辑的特定位点切割DNA链,同时导向RNA分子则会帮助Cas9酶类结合到预想链的DNA位点上,目前该过程的部分流程需要几个小时才能完成,这项研究中,研究人员能将整个过程缩短到几秒钟时间。
【4】Cell综述深度解读!基于CRISPR治疗性基因编辑领域的研究现状及未来展望!
doi:10.1016/j.cell.2020.03.023
日前,一项刊登在国际杂志Cell上题为“CRISPR-Based Therapeutic Genome Editing:Strategies and In Vivo Delivery by AAV Vectors”的综述文章中,来自马赛诸塞大学医学院等机构的科学家们描述了以CRISPR为基础的改善人类健康的策略,其重点是通过利用AAV载体将CRISPR疗法直接导入人体,此外,研究人员还讨论了目前广泛应用基于CRISPR疗法所要面临的挑战,并强调了持续的研究和技术革新对于推动基于CRISPR疗法在人类疾病研究中的重要性。
目前应用基于CRISPR的治疗性手段能直接应用于患者体内,有望治疗多种人类疾病,尽管基于CRISPR的工具箱能够对DNA和RNA编辑及基因表达调节进行多种操作,但其药物的运输仍然是该疗法发展的瓶颈,目前,腺相关病毒(AAV)载体是进行体内基因治疗的主要载体;AAV非常安全,其能将单链DNA(ssDNA)载体基因组运输到多个组织和细胞类型中,而且仅在一定剂量范围内具有轻度的免疫原性;尽管载体基因组在宿主细胞内大部分处于游离状态,但通过共分化和环化来介导有丝分裂后细胞内长期的转基因表达,就能使其稳定下来并产生持久的治疗效果,AAV载体在运输基因疗法到疾病动物模型和患者中推动了基于CRISPR疗法在治疗多种疾病中的应用。
【5】Nat Biotechnol:开发出能同时对多个基因组位点进行编辑的超强基因编辑工具—CHyMErA
doi:10.1038/s41587-020-0437-z
近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种新技术能同时对基因组中多个位点进行编辑,从而就有望帮助研究不同DNA的组合与人类健康和疾病的关联。基于CRISPR的DNA编辑技术能通过对任何人类基因进行精确剔除来研究其功能,从而就能彻底改变科学家们对人类基因组的研究,但目前研究人员仍然面临众多挑战,比如如何在相同细胞中同时移除多个基因或基因片段,这种类型的基因组“手术”对于科学家们而言,了解基因组不同部分在正常生理和疾病状况下是如何协同发挥作用的似乎更为重要。
如今研究人员开发了一种名为CHyMErA(Cas Hybrid for Multiplexed Editing and Screening applications)的新技术,其能应用到任何哺乳动物细胞中,同时系统性地靶向作用多个位点的DNA片段,CRISPR剪刀能通过导向RNA分子将DNA切割酶运送到基因组上的预想位点中,而使用最为广泛的DNA切割酶就是Cas9酶,自Cas9问世以来,科学家们一直寻找其它具有独特特性的Cas酶,以寻求改进和扩展该技术的应用;与CRISPR-Cas9技术不同的是,ChyMErA技术能将Cas9和Cas12a两种不同的DNA切割酶进行结合,从而实现多种用途,Cas12a酶是一种能用来在相同细胞中产生多个导向RNA分子的关键酶类,而这是同时进行DNA编辑的关键。
图片来源:Science, 2020, doi:10.1126/science.aba9844
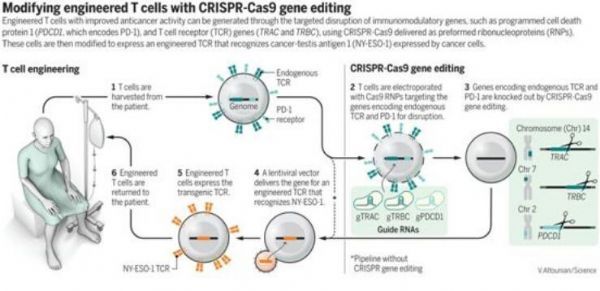
【6】Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
doi:10.1126/science.aba9844等
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗,相关研究结果发表在Science期刊上。
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。就这一指标而言,科学家们同意,它成功了。美国加州大学伯克利分校基因组编辑学者Fyodor Urnov(未参与这项研究)说,“这是一个决定性的转折点。”他说,这项研究在美国尚属首次,解答了“明显困扰了这个领域的问题”。
【7】Nature:新一代CRISPR基因编辑技术诞生,或为人体细胞提供多种功能
doi:10.1038/s41586-019-1711-4
近日,来自美国布罗德研究所的科学家们通开发了一种新的CRISPR基因组编辑方法,能够进一步提高基因编辑的效率与准确性。该系统称为“prime editing”,能够以精确,高效和高度通用的方式直接编辑人体细胞。该方法扩大了生物学和治疗学研究的基因编辑范围,并有可能校正多达89%的已知致病基因变异。
“分子生命科学的主要宗旨是能够达到在任何位置精确地改变基因组的能力。我们认为这一新开发的基因编辑技术使我们离这一目标更近”,该研究的作者之一David Liu说到。“prime editing”不同于以前的基因组编辑系统。Cas9蛋白是最早在人类细胞中进行基因组编辑的CRISPR工具,它是由布罗德研究所,麻省理工学院和哈佛大学率先开发。Cas9能够切割DNA链,从而可以在特定位置破坏靶基因,然后通过将新的DNA重组到靶位点而添加新的序列。
【8】PNAS:构建出提高CRISPR-Cas9基因编辑精确度的新变体---SaCas9-HF
doi:10.1073/pnas.1906843116
一项新的研究中,来自中国香港城市大学的研究人员开发出基因编辑技术CRISPR-Cas9的一种新变体,它有潜力在人类基因治疗期间提高基因编辑的精确度。相比于野生型CRISPR-Cas9,这种新变体降低了DNA中出现的意外变化,这表明它可能在需要高精确度的基因疗法中发挥作用。相关研究结果近期发表在PNAS期刊上。
CRISPR-Cas9是一种在细菌中首次发现的酶,可以经编程后在精确的基因组位点上切割和修复DNA,因而被称为“分子剪刀”。它可用于校正存在缺陷的DNA链,而且目前正在临床试验中测试它抗击癌症、血液疾病和遗传性失明的效果。这种技术被认为具有治疗数千种人类遗传疾病的潜力。
【9】Nat Biotechnol:通过降低DNA剪切速度来增强基因编辑特异性,脱靶指数降低3000倍
doi:10.1038/s41587-019-0186-z
在一项近日发表在Nature Biotechnology上题为"Enhancing gene editing specificity by attenuating DNA cleavage kinetics"研究中,来自Sangamo Therapeutics, Inc.公司的研究人员在Edward J. Rebar的带领下,发展了一种增强基因编辑特异性的新方法。
众所周知,工程化核酸酶因其介导高效基因组编辑的能力而受到广泛的关注。然而考虑到脱靶造成的基因剪切会产生潜在的致突变后果,这些酶的特异性仍然是一个问题,特别是在治疗应用。为此,研究人员开发了一种提高锌指核酸酶(ZFNs)特异性的方法,该方法对FokI催化域进行了重新设计,目的是减缓裂解,从而选择性地降低低亲和力离靶点的活性。研究人员在3对ZFN的FokI域中进行了单残基取代,保留了完全的目标活性,但是脱靶指数降低了3000倍。
【10】Science:基因编辑大牛张锋开发出新型基因编辑技术—CRISPR相关转座酶
doi:10.1126/science.aax9181
在一项新的研究中,来自美国麻省理工学院、布罗德研究所和美国国家卫生院(NIH)的研究人员发现CRISPR相关的转座子可用于将定制的基因插入到DNA中而不需要切割它。相关研究结果于2019年6月6日在线发表在Science期刊上,论文标题为“RNA-guided DNA insertion with CRISPR-associated transposases”。在这篇论文中,他们描述了他们的新型基因编辑技术,以及它在细菌基因组中进行测试时的效果。
近年来,CRISPR基因编辑技术因它具有治疗遗传性疾病的潜力而成为头条新闻。不幸的是,尽管围绕这种技术进行了大量研究,但它仍然不适合用于人类患者。这是因为这种技术容易出错---在切割DNA链时,CRISPR有时也会进行脱靶DNA切割,从而导致意料之外的不可预测的后果(有时会导致癌症)。在这项新的研究中,这些研究人员找到了一种方法,即将CRISPR与另一种蛋白结合使用,对DNA链进行编辑而不对它进行切割---他们称之为CRISPR相关转座酶(CRISPR-associated transposase, CAST)。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。