淋巴瘤(DLBCL)新药!CD19靶向新型免疫增强抗体Monjuvi+来那度胺:疗效优于临床常用方案,媲美CAR-T!
来源:本站原创 2021-12-17 00:56
Monjuvi+来那度胺方案,有潜力成为DLBCL的主干疗法。
DLBCL(图片来源:meddic.jp)
2021年12月16日讯 /生物谷BIOON/ --MorphoSys和Incyte近日在第63届美国血液学会年会和博览会(ASH 2021)公布了新型CD19靶向性Fc结构域优化免疫增强抗体Monjuvi(tafasitamab)治疗复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者RE-MIND2研究的额外现实世界数据。
该研究中,将Monjuvi+来那度胺方案与最常用的r/r DLBCL治疗方案进行了对比,包括:Polivy(polatuzumab vedotin)+苯达莫司汀+利妥昔单抗(Pola-BR)方案、利妥昔单抗+来那度胺(R2)方案、CD19 CAR-T细胞疗法。在来自200个临床地点的3454例患者中,分别有106、106、149例患者接受了pol-BR、R2、CAR-T治疗。在对比分析中,采用卡尺进行1:1最近邻匹配来创建匹配的患者对。配对包括:Monjuvi+来那度胺 vs Pola-BR,n=24对;Monjuvi+来那度胺 vs R2,n=33对;Monjuvi+来那度胺 vs CAR-T,n=37对。
结果显示,Monjuvi+来那度胺方案在多个终点上均有统计学上的显著差异。具体而言,结果显示,该研究达到了总生存期(OS)主要终点:(1)Monjuvi+来那度胺方案组与Pola-BR方案组相比OS有显著改善(20.1个月 vs 7.2个月;p=0.038);(2)Monjuvi+来那度胺方案组与R2方案组相比相比OS有显著改善(24.6个月 vs 7.4个月;p=0.014)。Monjuvi+来那度胺方案组与CAR-T方案组相比OS具有可比性,无统计学显著差异(22.5个月 vs 15个月)。
关键次要终点客观缓解率(ORR)方面,Monjuvi+来那度胺方案组与R2方案组相比有统计学意义的提高(63.6% vs 30.3%;p=0.013)。关键次要终点完全缓解率(CR)方面,Monjuvi+来那度胺方案组与R2方案组相比有统计学意义的提高(39.4% vs 15.2%;p=0.0514)。
虽然该研究未包括安全性终点,但与Monjuvi+来那度胺方案相关的最常见不良事件(AE)是感到疲劳或虚弱、腹泻、咳嗽、发烧、小腿或手肿胀、呼吸道感染和食欲下降。
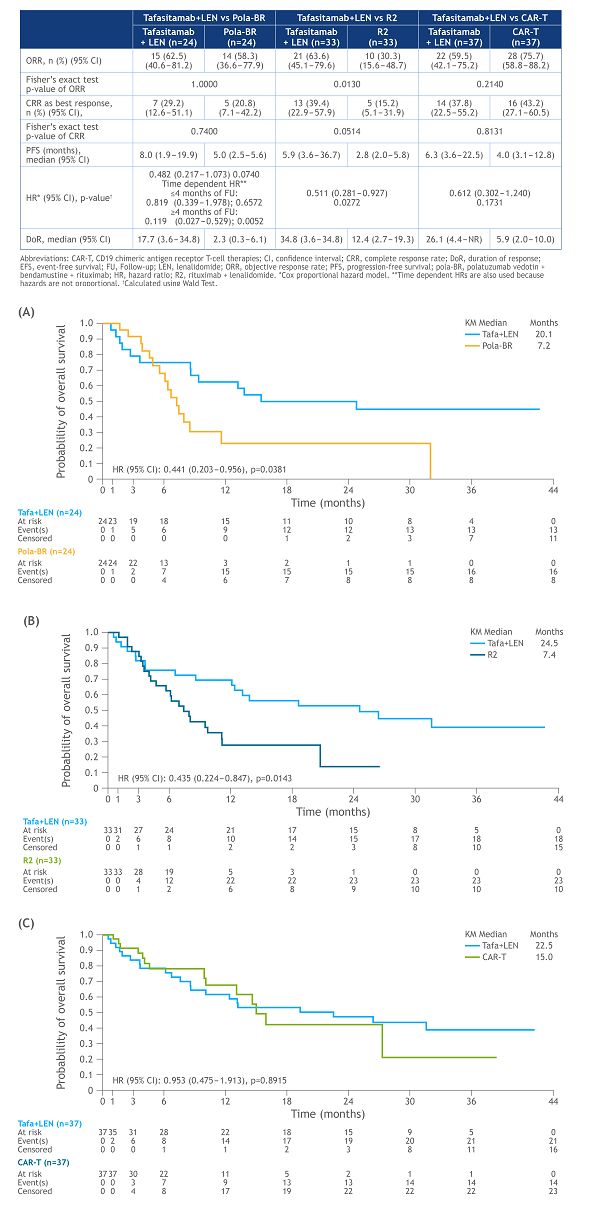
REMIND2研究结果(点击图片,查看大图)
RE-MIND2研究的首席研究员、梅奥诊所医学和肿瘤学教授Grzegorz Nowakowski医学博士表示:“在这项回顾性队列分析中,观察到统计学上显著的OS差异,在不符合移植条件的复发或难治性DLBCL患者中,Monjuvi+来那度胺方案优于Pola-BR方案和R2方案,这是一个传统上难以治疗的人群。我们对Monjuvi+来那度胺方案的OS差异以及该方案与CAR-T之间可比的OS感到鼓舞,特别是Monjuvi+来那度胺方案有潜力带来潜在的延长生存益处。”
MorphoSys高级副总裁兼全球医疗事务主管Nuwan Kurukulasuriya博士表示:“RE-MIND2研究是我们继续致力于产生与实践相关的现实世界证据的一个例子,总体而言,它更真实地捕捉了癌症的临床异质性,并使我们有更多的机会动态评估患者体验。这些数据表明,Monjuvi+来那度胺方案是一种有意义的选择,有潜力成为DLBCL未来的主干疗法。”
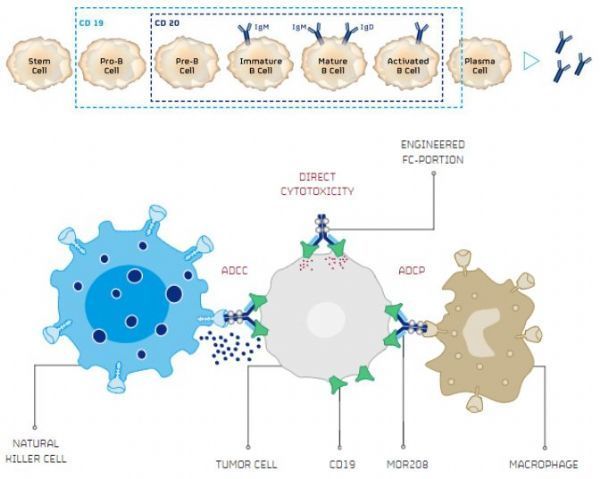
B细胞各发育阶段CD19表达及tafasitamab作用机制(点击图片,查看大图)
2020年7月底,Monjuvi获得美国FDA批准,联合来那度胺,用于治疗不适合自体干细胞移植(ASCT)的复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者,包括源于低级别淋巴瘤的DLBCL。值得一提的是,Monjuvi是第一个获FDA批准用于一线治疗期间或治疗后病情进展的r/r DLBCL成人患者的二线疗法。此前,FDA已授予了Monjuvi快速通道资格、突破性药物资格、优先审查资格。
Monjuvi的活性药物成分为tafasitamab,这是一种新型人源化Fc结构域优化的溶细胞性CD19靶向性免疫增强单克隆抗体,旨在有效地靶向B细胞特异性抗原CD19并诱导免疫细胞活化。CD19是多种B细胞恶性肿瘤的一个明确生物标志物。目前,tafasitamab正处于临床开发,用于治疗多种B细胞恶性肿瘤。
tafasitamab是一种靶向CD19的新型人源化Fc增强单克隆抗体,其Fc结构域进行了修饰(包含2个氨基酸取代S239D和I332E),通过提高对效应细胞上激活型FcγRIIIa的亲和力,显著增强抗体依赖性细胞介导的细胞毒性(ADCC)和抗体依赖性细胞吞噬(ADCP),从而改善肿瘤细胞杀伤的关键机制。临床前模型研究中,tafasitamab已被证实通过结合CD19可诱导癌细胞直接凋亡。
目前,tafasitamab正被开发用于2种B细胞恶性肿瘤,包括慢性淋巴细胞白血病(CLL)和DLBCL。在全球范围内,CLL是成人中最常见的白血病类型,DLBCL是成人中最常见类型的非霍奇金淋巴瘤(NHL),占所有NHL病例的40%。DLBCL是一种影响免疫系统B细胞的侵袭性疾病,其特征是淋巴结、脾脏、肝脏、骨髓或其他器官中的恶性B细胞迅速生长。30%-40%的患者对初始治疗无应答或之后复发,对有效的治疗方法存在着显著未满足的医疗需求。在美国,每年约有10000例患者被诊断为不符合ASCT条件的r/r DLBCL。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


