银屑病创新药!口服TYK2抑制剂Sotyktu(deucravacitinib)获美国FDA批准!
来源:生物谷原创 2022-09-23 17:09
Sotyktu是全球唯一获批的TYK2抑制剂,也是近10年来中重度斑块型银屑病口服治疗的首个创新。

图片来源:摄图网
2022年09月23日讯 /生物谷BIOON/ --百时美施贵宝(BMS)近日宣布,美国食品和药物管理局(FDA)已批准新型口服抗炎药Sotyktu(deucravacitinib):用于治疗适合系统治疗或光疗的中度至重度斑块型银屑病成人患者。Sotyktu不建议与其他强效免疫抑制剂联合使用。目前,Sotyktu也正在接受欧盟和日本监管机构的审查。
Sotyktu是一种首创的、口服、选择性、变构酪氨酸激酶2(TYK2)抑制剂,是全球唯一获批的TYK2抑制剂,也是近10年来中重度斑块型银屑病口服治疗的首个创新。Sotyktu具有一种新的作用机制,将为中重度斑块型银屑病患者群体带来一种受欢迎的新一线口服治疗方案。
此次批准,基于2项关键3期临床试验(POETYK PSO-1,POETYK-PSO-2)的结果。这2项试验在1684名年龄在18岁及以上的中重度斑块型银屑病成人患者中开展,结果证实:Sotyktu(每日口服1次)在改善皮损清除方面,疗效优于安慰剂和Otezla(apremissat,每日口服2次)。与安慰剂和Otezla相比,Sotyktu在第16周和第24周表现出了优越的疗效,并且Sotyktu治疗应答一直持续至第52周。
2项试验中,Sotyktu具有良好的安全性和耐受性。接受Sotyktu治疗的患者中,最常见的不良反应(≥1%且高于安慰剂)包括:上呼吸道感染(19.2%)、血肌酸激酶升高(2.7%)、单纯疱疹(2.0%)、口腔溃疡(1.9%)、毛囊炎(1.7%)和痤疮(1.4%)。此外,Sotyktu治疗组有2.4%、安慰剂组有3.8%、Otezla治疗组有5.2%的患者因不良反应导致停药。
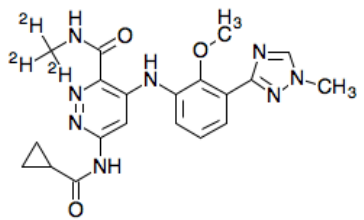
deucravacitinib化学结构式(图片来源:wikipedia.org)
Sotyktu的活性药物成分为deucravacitinib,这是一种首创(first-in-class)、口服、选择性、变构酪氨酸激酶2(TYK2)抑制剂,具有一种不同于其他激酶抑制剂的独特作用机制,代表着一类新的小分子药物,该药是进入临床研究评估治疗多种免疫介导性疾病的第一个TYK2抑制剂。
deucravacitinib由百时美施贵宝科学家设计,选择性靶向TYK2。TYK2是一种细胞内信号激酶,介导IL-23、IL-12、I型IFN的信号传导,这些细胞因子是参与多种免疫介导疾病发病机制的关键细胞因子。deucravacitinib通过与TYK2的调节域结合实现高度选择性,从而导致TYK2及其下游功能的变构抑制。deucravacitinib在生理相关浓度下选择性抑制TYK2。在治疗剂量下,deucravacitinib不抑制JAK1、JAK2或JAK3。
目前,deucravacitinib正在多项全球临床试验中评估治疗免疫介导疾病,包括银屑病、银屑病关节炎、狼疮、炎症性肠病。此前,医药市场调研机构EvaluatePharma发布报告预测,deucravacitinib上市后,在2026年的销售额将达到22.1亿美元。(生物谷Bioon.com)
原文出处:U.S. Food and Drug Administration Approves Sotyktu™ (deucravacitinib), Oral Treatment for Adults with Moderate-to-Severe Plaque Psoriasis
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


