研究揭示去泛素化酶USP33调控线粒体自噬新机制
来源:北京基因组研究所 2019-09-03 12:45
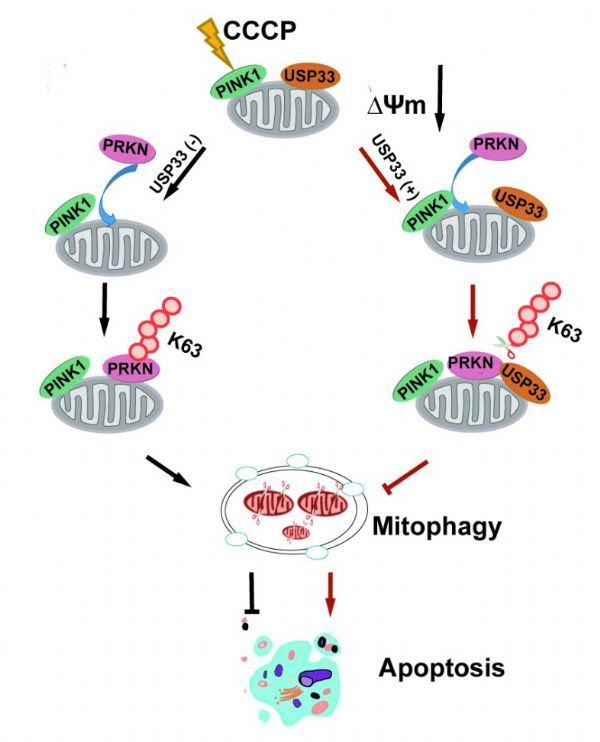
PINK1-Parkin介导的线粒体自噬在线粒体质量控制过程中发挥着关键作用,其调控异常与人类神经退行性疾病发生相关。已有研究表明Parkin蛋白泛素化和去泛素化修饰参与线粒体自噬调控过程,但Parkin蛋白的去泛素化酶及其调控线粒体自噬的分子机制尚不清楚。中国科学院北京基因组研究所赵永良研究组发现,去泛素化酶USP33通过去除Parkin蛋白Lys435位点的K63泛素链来调控线粒体
PINK1-Parkin介导的线粒体自噬在线粒体质量控制过程中发挥着关键作用,其调控异常与人类神经退行性疾病发生相关。已有研究表明Parkin蛋白泛素化和去泛素化修饰参与线粒体自噬调控过程,但Parkin蛋白的去泛素化酶及其调控线粒体自噬的分子机制尚不清楚。
中国科学院北京基因组研究所赵永良研究组发现,去泛素化酶USP33通过去除Parkin蛋白Lys435位点的K63泛素链来调控线粒体自噬的发生,进而调控神经毒性剂MPTP诱导的神经肿瘤细胞的凋亡。相关研究成果在8月26日以USP33 deubiquitinates PRKN/parkin and antagonizes its role in mitophagy 为题在线发表于Autophagy 杂志。
研究团队首次证明去泛素化酶USP33定位于线粒体外膜,利用质谱分析和免疫共沉淀技术发现与E3泛素连接酶Parkin存在直接相互作用。细胞和体外实验证实USP33能够去除与Parkin相结合的K6、K11、K48和K63泛素化链。在线粒体解偶联剂CCCP处理下,敲低USP33会促进Parkin转位到线粒体,从而增强线粒体自噬并有效清除损伤的线粒体。进一步实验证实USP33主要通过去除Parkin蛋白Lys435位点的K63泛素化链而调控线粒体自噬的发生。敲低USP33能够抑制神经毒性剂MPTP处理下SH-SY5Y细胞的凋亡。
该研究揭示了去泛素化酶USP33在调控线粒体自噬方面的新机制,解析了泛素化和去泛素化动态平衡对线粒体自稳态维持的关键作用,相关研究为阐明线粒体自噬发生的分子机制和生物学功能提供了重要依据,为相关神经性疾病的防治提供了新的靶点。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。