EMBO Mol Med:调控肥胖的新蛋白激酶被发现!
来源:生物谷 2021-05-27 15:06
2021年5月25日讯/生物谷/BIOON/---近日,乌尔兹堡大学研究者在EMBO Mol Med杂志上发表了题为Protein Kinase D2 drives chylomicron-mediated lipid transport in the intestine and promotes obesity的文章。脂质是饮食中能量密度最高的成分,它们的
2021年5月25日讯/生物谷/BIOON/---近日,乌尔兹堡大学研究者在EMBO Mol Med杂志上发表了题为Protein Kinase D2 drives chylomicron-mediated lipid transport in the intestine and promotes obesity的文章。脂质是饮食中能量密度最高的成分,它们的过度消耗会导致肥胖和糖尿病。膳食脂肪含量与肠道的脂质加工活性及其吸收甘油三酯(TG)的总体能力有关。然而,在饮食脂肪增加的情况下,驱动肠道脂肪吸收的信号级联反应在很大程度上是未知的。在这里,作者描述了蛋白激酶D2(PKD2)在脂质稳态中一个意想不到的作用。
图片来源:doi: 10.15252/emmm.202013548.
饮食类型在调节机体新陈代谢方面起着重要作用。脂肪含量增加的饮食通常能量密度更高,这会促进正能量平衡,从而导致肥胖。消化系统是第一个受到饮食中脂肪水平升高的挑战的地方。在胆汁酸将摄入的脂肪乳化后,小肠中的胰腺脂肪酶将甘油三酯分解成甘油、单甘酯和脂肪酸(FAs)。单甘酯和脂肪酸随后被肠细胞被动扩散或通过涉及FA转运蛋白的主动机制,如分化簇36(CD36)摄取。在肠细胞中,脂肪酸和单甘酯或甘油在内质网(ER)重新酯化。这些单甘酯和3-磷酸甘油途径是肠细胞合成甘油三酯的主要途径。再酯化后,TG被微粒体转移蛋白(MTTP)与载脂蛋白B48(APOB48)和载脂蛋白A4(APOA4)一起包装成前乳糜粒。APOB48是内质网前乳糜微管形成所必需的,而APOA4可能负责决定最终乳糜微管的大小。在它们组装之后,前乳糜微粒被运送到高尔基体进行进一步的化学修饰(可能包括脂化),最后被指定用于分泌。
膳食脂肪含量的增加导致脂肪摄取、脂肪酸再酯化、甘油三酯堆积和组装前乳糜微粒所需的脂蛋白等关键酶的表达和活性增加。有趣的是,乳糜管大小的增加可能是决定肠细胞处理过量膳食脂肪能力增强的主要因素。然而,驱动肠细胞适应肠腔内脂质负荷增加的信号级联反应在很大程度上仍不清楚。
蛋白激酶D(PKD)家族成员是二酰甘油(DAG)和蛋白激酶C(PKC)效应物,它们是新近出现的营养动态平衡的中枢调节因子。PKD家族包括三个成员(PKD1、PKD2和PKD3),它们调节细胞代谢和病理生理的几个方面。作者最近的研究表明,PKD可能是对游离脂肪酸(FFA)或DAG的反应而被激活。此外,高脂饮食(HFD)喂养激活了肝脏中的PKD。然而,到目前为止,PKDS活性对肠道脂质代谢的影响还没有研究。
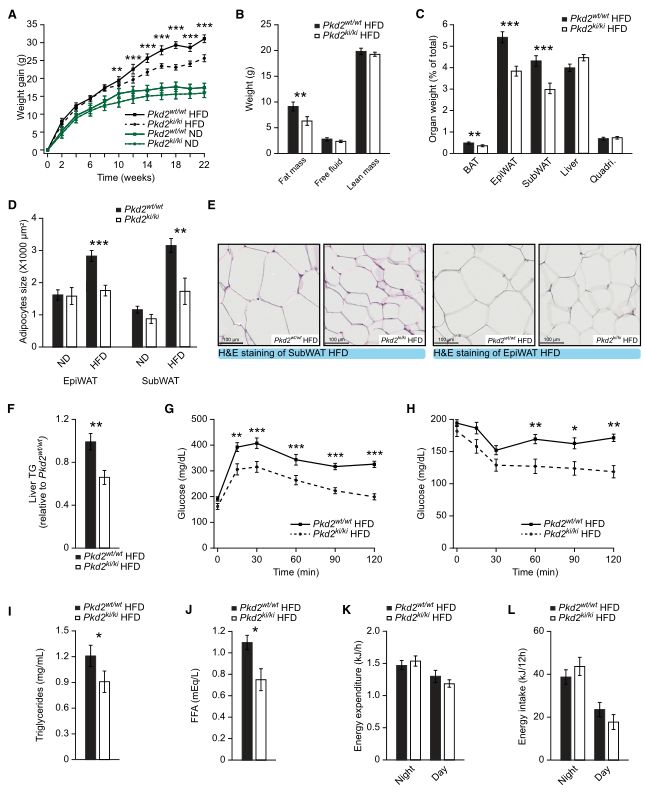
PKD2失活对饮食诱导的肥胖有保护作用
图片来源:doi: 10.15252/emmm.202013548.
在这里,作者发现PKD2(也称为PRKD2)在肠道脂质负载时被激活,并促进人和小鼠肠细胞乳糜微粒的生长和脂化,从而促进TG的分泌。有趣的是,PKD2直接磷酸化与乳糜粒相关的载脂蛋白之一,即载脂蛋白A4。在小鼠肠道或人类肠道细胞中PKD2的缺失导致细胞内和分泌的APOA4丰度增加。与这些结果一致的是,肠道中PKD2活性的消融或该激酶的特异性缺失导致脂肪吸收减少,粪便能量排泄增加,并对高脂饮食诱导的肥胖产生抵抗力。此外,PKD2的缺失导致了对高脂饮食诱导的糖尿病的抵抗力和肠道微生物区系的病理变化。此外,作者还证明了PKD特异性抑制剂可以减少脂肪的吸收,在动物模型中对肥胖和相关疾病的治疗是有效的。最后,作者的数据表明,人体肠道中PKD2的活性与血液中的甘油三酯水平相关。因此,作者确定PKD2是肠道脂肪吸收的关键成分,也是未来减肥治疗的一个有吸引力的靶点。(生物谷 Bioon.com)
参考资料:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



