Nature子刊重大突破:纳米颗粒实现器官特异性基因编辑!
来源:本站原创 2020-04-07 00:01
2020年4月7日讯 /生物谷BIOON /--含遗传药物的脂质纳米粒可以通过生物工程调整其生物分布,诱导器官特异性基因调控。脂质纳米颗粒(LNP)技术使一种小干扰siRNA (siRNA)药物的临床转化和首次获得美国食品和药物管理局(FDA)的批准成为可能。该纳米药物是为治疗遗传性疾病转胸腺视蛋白介导的淀粉样变性引起的多神经病而开发的,它依赖于高效的lnp
脂质纳米颗粒(LNP)技术使一种小干扰siRNA (siRNA)药物的临床转化和首次获得美国食品和药物管理局(FDA)的批准成为可能。该纳米药物是为治疗遗传性疾病转胸腺视蛋白介导的淀粉样变性引起的多神经病而开发的,它依赖于高效的lnp介导的siRNA在静脉滴注后传递到肝细胞,从而抑制病理蛋白的产生。LNP系统还允许信使RNA (mRNA)的包封,以诱导治疗性蛋白的产生,并允许基因编辑复合物全身给药后纠正肝细胞中的致病突变。然而,在肝脏以外的组织和器官中实现治疗相关的基因调控仍是一个未解之谜。
图片来源:Nature Nanotechnology
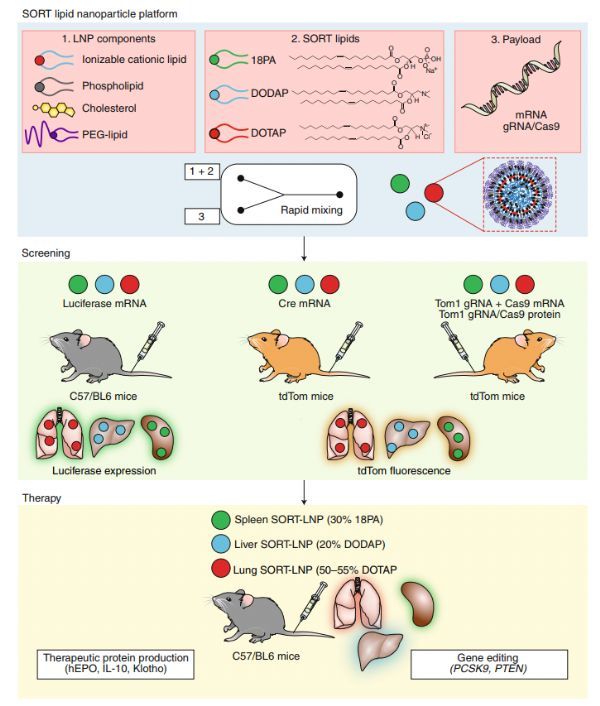
在最新一期Nature Nanotechnology上,Qiang Cheng等人提出了一种称为选择性器官靶向(SORT)的方法,通过生物工程将含有核酸疗法的LNPs诱导肝脏、脾脏和肺特异性基因调控。LNP系统通常由磷脂、胆固醇、聚乙二醇(PEG)脂质和可电离的阳离子脂质组成。每个LNP成分及其摩尔比都已被优化,以确保高效的核酸递送到肝细胞。特别是,合理设计和筛选可电离的阳离子脂质(或类脂质)文库对于实现临床应用相关剂量的肝基因沉默至关重要。最有效的电离阳离子脂质,其特征是明显的pKa值在6.2和6.5之间,具有三种功能:(1)在LNP生产期间,酸性pH值下质子化的叔胺脂质头部促进其与带负电荷的核酸结合,(2)在生理的pH值,附近无电荷的脂质确保净中性表面电荷,以减少免疫反应和循环时间延长和(3)细胞摄取后进入酸化的内体中,正电荷脂质促进膜融合和有效的胞质递送。
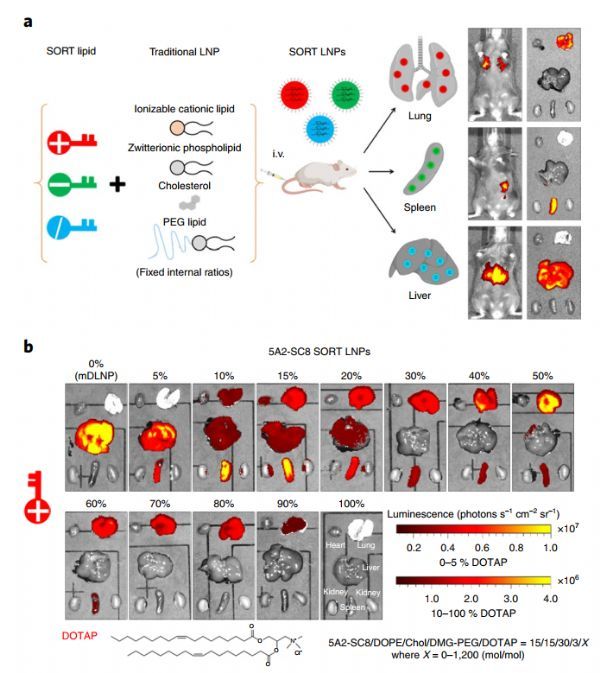
在这种SORT方法中,作者添加五分之一脂质成分来通过静脉注射递送功能信使核糖核酸或基因编辑复合物道特定组织。使用一个快速的混合过程,这种SORT脂质 (永久的阳离子和阴离子或可质子化的阳离子)和不同摩尔比的其他材料生成一个脂质体文库,包载mRNA编码荧光素酶进行体内筛选。通过增加永久性阳离子脂质1,2-二烯烃-3-三甲氨基丙烷(DOTAP)的摩尔百分比(0-100%),可使荧光素酶的表达在静脉注射后从肝脏转移到脾脏和肺。LNPs中加入10-40%的永久性阴离子脂质1,2-二烯醇化酶-sn-甘油-3-磷酸(18PA)可在脾脏中特异性表达荧光素酶。加入20%的其他可电离的阳离子脂类,如1,2-二烯酰-3-二甲基氨基甲烷-丙烷(DODAP),不会改变生物分布,但增加了mRNA对肝脏的递送。该方法的普遍性通过将LNP与其他永久性带电或可电离的阳离子脂类功能化而得到证实,这导致了器官表达的类似变化,且表现出与脂类相关的方式。值得注意的是,SORT-LNP的疗效离不开可电离的阳离子脂质包合。给予肺、脾脏和肝脏特异性mRNA SORT-LNP的筛选结果表明,基于荧光素酶的筛选可产生持续的治疗性蛋白,且无明显毒性。重要的是,SORT方法还允许调节LNPs组织特异性荧光素酶的表达,使其与临床批准的Onpattro配方相同。
Cheng等人也报道了使用SORT-LNPs进行组织特异性CRISPR/Cas基因编辑。相对于治疗性基因沉默或表达,基于CRISPR/Cas的基因编辑需要(至少)两个组成部分:引导RNA (guide RNA, gRNA)识别目标DNA和Cas核酸酶进行双链断裂。作者生成了包含gRNA和Cas9 mRNA或gRNA/Cas9核糖核酸蛋白复合物的SORT-LNPs,并在肝外组织中进行了基因编辑。在红色荧光蛋白tdTomato报告小鼠中,不同种类的LNP剂型可选择性诱导肝、肺、脾特异性基因编辑。此外,作者还展示了内源性靶基因(PTEN)和治疗性靶基因(PCSK9)的组织特异性编辑。
图片来源:Nature Nanotechnology
Cheng等人的研究的主要创新点是在复杂的报告模型中采用了系统的LNP筛选方法。Sago等人报道了一种类似的方法,称为纳米颗粒传递的快速识别(FIND)。他们的策略包括筛选数百个LNPs,以确定使用合理设计的DNA条形码将功能性mRNA(和其他RNA疗法)递送到各种组织的有效配方。
LNP技术可以直接在特定组织(和细胞)中实现治疗性基因调控的前提是令人兴奋的,因为它可能会使器官特异性基因治疗成为可能,用于治疗囊性纤维化(肺)、淋巴瘤(脾)或免疫紊乱。虽然作者推测了明显的pKa值改变和独特的蛋白冠,但需要精确的机制研究来揭示SORT修饰如何将LNPs重定向到特定的组织。根据这一思路,先前有报道称调节mRNA脂质复合物的净电荷可以调控组织特异性抗原提呈细胞的荧光素酶表达。系统给药后,阳性mRNA脂质复合物主要在肺组织中表达,而降低阳离子脂质含量则使其表达转移至脾脏。进一步研究LNP的器官和组织特异性使得进一步微调成为可能。然而,可能的免疫原性和输液相关的影响需要深入研究,然后才能实现SORT方法,以合理设计用于治疗性基因修饰肝脏以外器官的LNP转化配方。(生物谷Bioon.com)
参考资料:
【2】Cheng, Q., Wei, T., Farbiak, L. et al. Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR-Cas gene editing. Nat. Nanotechnol. (2020). https://doi.org/10.1038/s41565-020-0669-6
【4】Kranz, L., Diken, M., Haas, H. et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 534, 396-401 (2016). https://doi.org/10.1038/nature18300
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->