移植相关血栓性微血管病(HSCT-TMA)疗法!MASP-2靶向单抗narsoplimab在美国监管更新!
来源:本站原创 2022-01-21 01:10
TMA是干细胞移植最常见的致命并发症,目前尚无治疗HSCT-TMA的疗法!
2022年01月20日讯 /生物谷BIOON/ --Omeros Corporation近日宣布,该公司已于本月早些时候向美国食品和药物管理局(FDA)提交了针对该机构关于narsoplimab(OMS721)治疗造血干细胞移植相关血栓性微血管病(HSCT-TMA)的完整回应函(CRL)的回复。该回复包括与外部临床、监管、法律专家密切合作起草的综合简报包,详细阐述了FDA在CRL中提出的要点。Omeros公司已要求与FDA召开A类会议,以解决任何未决项目。
在临床治疗中,患者在接受造血干细胞移植(HSCT)之后,通常会有复杂的临床病程,并且通常病情严重。血栓性微血管病(TMA)是干细胞移植中最常见的致命并发症,HSCT-TMA会增加病情复杂性并恶化结局。目前,还没有批准用于治疗HSCT-TMA的疗法。
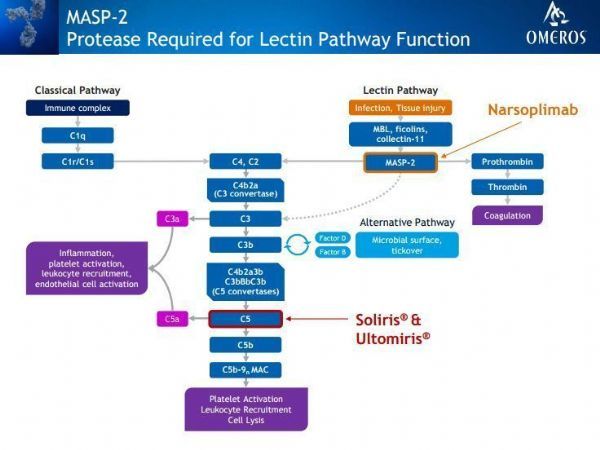
narsoplimab是第一个在治疗HSCT-TMA方面申请FDA批准的候选药物。该药在HSCT-TMA和IgA肾病方面已被授予突破性疗法认定(BTD)和孤儿药资格(ODD)。narsoplimab是一种单克隆抗体,靶向甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2),这是补体系统凝集素途径的效应酶。
2021年10月,美国FDA针对单抗药物narsoplimab治疗造血干细胞移植相关血栓性微血管病(HSCT-TMA)的生物制品许可申请(BLA)发布了一封CRL。2021年5月,FDA曾推迟了该BLA的目标决定日期。根据Omeros公司之前发布的公告,在CRL中,FDA表示难以估计narsoplimab在HSCT-TMA中的治疗效果,需要更多信息来支持监管批准。在CRL中,没有提出化学、制造和控制(CMC)、安全或非临床问题。
Omeros公司仍然对narsoplimab在HSCT-TMA中的疗效和安全性数据充满信心。该公司在临床开发项目方面与FDA进行了密切合作,包括支持批准的单臂试验和作为主要终点的应答定义。
narsoplimab疗效数据
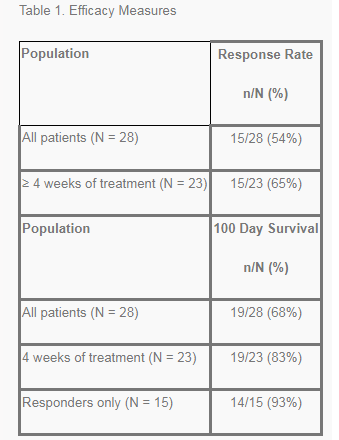
narsoplimab BLA中纳入的临床部分基于先前报道的在HSCT-TMA中进行的关键3期临床试验的结果。在该试验中,narsoplimab治疗的疗效数据显著超越了与美国FDA商定的关于主要疗效终点的阈值,并且在次要终点上表现出相似的强烈治疗反应。这项III期试验是一项开放标签、单臂研究,不包括对照组、历史对照或其他。研究共涉及28例高危HSCT-TMA患者,研究的主要终点是完全缓解率(CRR),与FDA达成一致的CRR疗效阈值为15%。该研究中所有患者已经完成治疗,2020年6月公布的结果如下:
主要终点:研究人群的CRR以及95%可信区间(95%CI)的下限值明显超越疗效阈值(15%),在接受至少一剂narsoplimab治疗的患者中,CRR为54%(95%CI:34-72,p<0.0001);在按方案规定接受至少4周narsoplimab治疗的患者中,CRR为65%(95%CI:43-84,p<0.0001)。
次要终点:(1)100天生存率(定义为从HSCT-TMA诊断之日起的生存率)方面达到超出专家预期(低于20%):在所有接受治疗的患者中为68%、在按方案规定接受至少4周narsoplimab治疗的患者中为83%、在对narsoplimab治疗有应答的患者中为93%。而熟悉关键试验数据的专家,预期试验人群的100天生存率低于20%。(2)实验室次要疗效终点的初步结果(从治疗前基线至每个实验室值的变化)继续显示出有意义的改善,并在血小板计数(p=0.001)、乳酸脱氢酶(LDH,p=0.008)、结合珠蛋白(p<0.001)方面达到统计学和临床意义意义。
安全性:试验中最常见的不良反应是腹泻、恶心、呕吐、低钾血症、中性粒细胞减少和发热,这些都是干细胞移植患者常见的不良反应。在试验过程中有6人死亡,这些都是由于败血症、基础疾病的进展、移植物抗宿主病引起,所有这些均为这一患者群体中常见的死亡原因。
narsoplimab作用机制
HSCT-TMA是造血干细胞移植(HSCT)的一种严重且常常致死性的并发症,这是一种系统性的、多因素的疾病,由与干细胞移植相关的预处理方案、免疫抑制疗法、感染、移植物抗宿主病(GvHD)和其他因素诱导的内皮细胞损伤引起。内皮损伤激活补体凝集素途径,在HSCT-TMA的发生发展中起重要作用。这种情况可发生在自体和异体移植中,但在异体移植中更为常见。在美国和欧洲,每年大约要进行25000到30000例同种异体移植。最近在成人和儿童异基因干细胞移植人群中的报告发现,HSCT-TMA的发生率约为40%,其中高达80%的患者可能存在高危特征。在严重的HSCT-TMA病例中,死亡率可能超过90%,甚至在存活的患者中,长期肾功能衰竭也很常见。目前,HSCT-TMA没有批准的疗法或护理标准。
narsoplimab是一种全人IgG4单克隆抗体,以甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2)为靶点,开发用于治疗HSCT-TMA。MASP-2是一种新的促炎蛋白靶点和补体系统凝集素途径的效应酶。凝集素途径主要由组织损伤或微生物感染激活。重要的是,与市面上或开发中的其他补体靶向药物不同,narsoplimab对MASP-2的抑制作用并不干扰经典补体途径,后者是获得性感染免疫应答的关键组成部分。narsoplimab的作用是防止补体介导的炎症和内皮损伤,而不影响其他先天免疫途径的功能。目前,Omeros公司控制着MASP-2和所有MASP-2靶向疗法的全球权利。
此前,narsoplimab在美国已被授予治疗高危HSCT-TMA患者的突破性药物资格、预防补体介导的血栓性微血管病(TMA)和治疗HSCT-TMA的孤儿药资格,在欧盟被授予治疗造血干细胞移植(HSCT)的孤儿药资格。目前,narsoplimab也正处于III期临床,开发用于IgA肾病(IgAN)和非典型溶血性尿毒症综合征(aHUS)。之前,该药在美国还被授予治疗IgAN的孤儿药和突破性药物资格、治疗aHUS的快速通道资格,在欧盟被授予治疗IgAN的孤儿药资格。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->