Immunity:自噬调节内皮连接以抑制炎症期间中性粒细胞的渗出
来源:生物谷 2021-08-27 17:09
中性粒细胞从血液循环迁移到感染或损伤部位是一种关键的免疫反应,需要破坏血管内部的内皮细胞(EC),而不受调控的中性粒细胞跨内皮细胞迁移(TEM)是致病性的,但其生理终止的分子基础仍然未知。
中性粒细胞从血液循环迁移到感染或损伤部位是一种关键的免疫反应,需要破坏血管内部的内皮细胞(EC),而不受调控的中性粒细胞跨内皮细胞迁移(TEM)是致病性的,但其生理终止的分子基础仍然未知。巨自噬/经典自噬是一种进化保守过程,能够将细胞质内容物递送至溶酶体进行降解,典型自噬已成为先天免疫功能的中心调节器,包括细胞因子的产生、免疫细胞的分化和病原体清除。虽然有足够的证据表明免疫细胞自噬相关基因调节炎症,但对EC 自噬在这方面的作用知之甚少,然而,自噬是许多EC功能的稳态调节剂,最显著的是EC存活和发育性血管生成,并且是许多血管疾病的关键调节剂。
图片来源:https://doi.org/10.1016/j.immuni.2021.07.012
该研究证明了发炎组织中小静脉的EC表现出强大的自噬反应,该反应在时间上与中性粒细胞运输的峰值一致,并且严格定位于EC接触。 EC自噬的遗传消融导致小鼠炎症模型中过度的中性粒细胞TEM和不受控制的白细胞迁移,而自噬的药理学诱导抑制中性粒细胞浸润到组织中。从机制上讲,自噬调节EC连接的重塑和关键EC粘附分子的表达,促进它们的细胞内运输和降解。该研究确定自噬是一种旨在终止生理炎症的EC白细胞运输机制的调节剂。
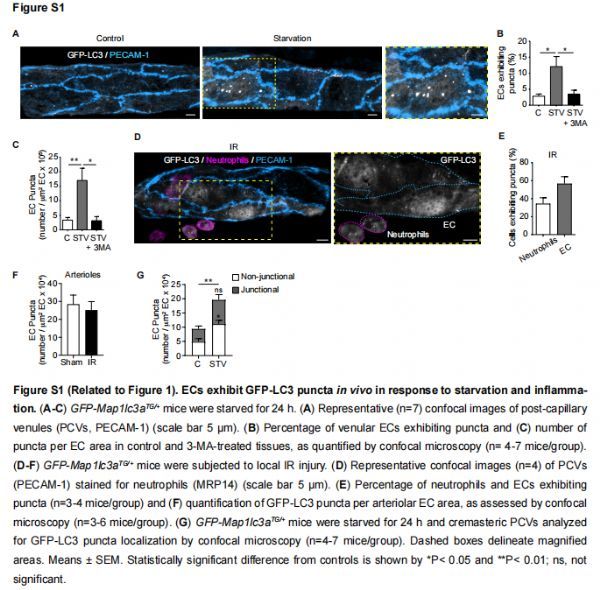
ECs在体内表现出GFP-LC3斑点以响应饥饿和炎症 图片来源:https://doi.org/10.1016/j.immuni.2021.07.012
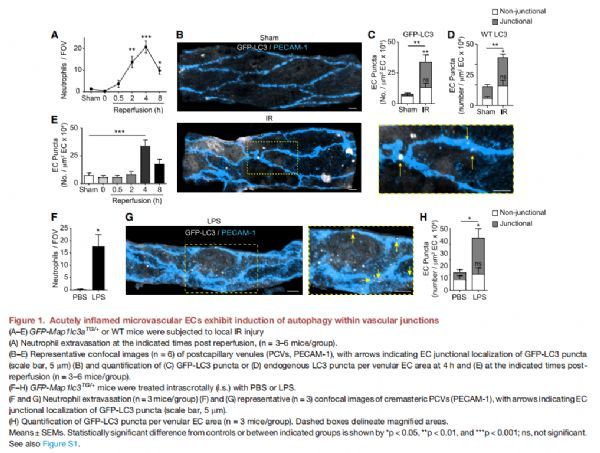
急性发炎的微血管EC在血管连接处表现出自噬诱导 图片来源:https://doi.org/10.1016/j.immuni.2021.07.012
为了研究自噬在体内与中性粒细胞转运的时间谱相关的潜在作用,研究者建立了一种共聚焦显微镜方法,使用GFP-LC3转基因小鼠(GFP-Map1lc3aTG/+),观察和量化睾提肌的毛细血管后小静脉(PCVs)中LC3点的形成。最初的实验检测到微静脉ECs中GFP-LC3斑点的数量增加以响应营养饥饿,这是一种有效的典型自噬刺激剂;局部给药III类磷脂酰肌醇3-激酶(PI3K)抑制剂3-甲基腺嘌呤(3MA),这是一种成熟的饥饿诱导自噬体形成阻滞剂,显著降低ECs中显示GFP-LC3点的总ECs的百分比和这些细胞器的数量。
该研究还探讨了在缺血再灌注损伤的急性炎症模型(IR;缺血40分钟,然后再灌注长达8小时)过程中这种反应的发生率,这种反应的特点是在再灌注阶段中性粒细胞大量但短暂的浸润,在4小时达到峰值,再灌注后8小时下降到基础水平。在接受IR(4小时再灌注)的组织中,迁移的中性粒细胞表现出GFP-LC3斑点;IR后,动脉ECs的GFP-LC3斑点数没有变化,但静脉ECs 表现出自噬反应的强劲增加;与饥饿后更弥散的斑点分布不同,在IR刺激的小静脉中,这种增加完全是由于PECAM-1+ EC接触处存在GFP-LC3斑点所致。通过免疫荧光(IF)染色对内源性LC3斑点进行的量化显示出类似的结果,说明GFP-LC3和EC中的野生型(WT)蛋白之间的相似活性。在研究自噬诱导的时间过程中,GFP-LC3斑点形成仅在中性粒细胞迁移反应的峰值处显着,并在中性粒细胞浸润停止阶段向控制量下降;脂多糖(LPS)刺激的组织(4小时),同样以中性粒细胞浸润为特征,表现出类似的EC连接GFP-LC3点位。这些结果表明,在中性粒细胞炎症反应时,EC在细胞-细胞接触处显示出增加的LC3斑点,表明自噬过程可能在调节EC连接中发挥作用,因此免疫细胞浸润到组织中。
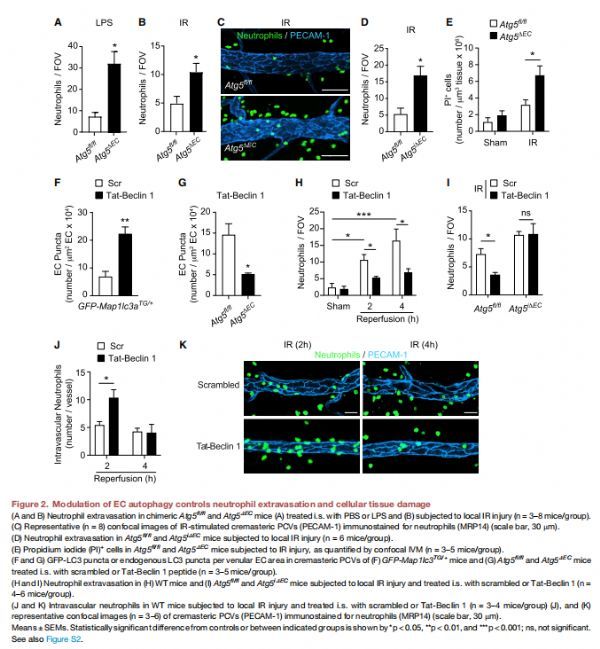
EC自噬的调节控制中性粒细胞外渗和细胞组织损伤 图片来源:https://doi.org/10.1016/j.immuni.2021.07.012
该研究评估了EC自噬缺陷对中性粒细胞TEM的影响,使用了组成型EC Atg5缺失模型,为了额外提供一种实时跟踪中性粒细胞迁移的方法,通过骨髓移植从Lyz2-EGFP基因靶向小鼠到受照射的Atg5ΔEC 和 Atg5fl/fl小鼠产生嵌合小鼠。对局部LPS刺激或接受IR(4小时再灌注)的小鼠提睾肌中的总中性粒细胞浸润的分析表明,与嵌合 Atg5fl/fl对照相比,嵌合Atg5ΔEC小鼠的中性粒细胞浸润增加。类似地,可诱导的EC自噬缺陷小鼠Atg5iΔEC在提睾肌IR后表现出升高的中性粒细胞浸润反应;在研究由EC自噬缺陷引起的强烈中性粒细胞浸润的潜在病理生理后果时,碘化丙啶阳性表明Atg5ΔEC小鼠发炎组织中受损细胞数量增加。这些结果表明 EC自噬在中性粒细胞浸润到体内急性炎症组织中的负调节作用,提供了保护宿主免受过度中性粒细胞介导的组织损伤的机制,为此,研究者使用了一种细胞渗透自噬诱导肽Tat-Beclin1,它可以激活自噬的主要调节因子Beclin1。Tat-Beclin 1的局部应用,以ATG5依赖性方式在小静脉ECs中诱导GFP-LC3和内源性LC3斑点,它的药理学策略抑制了IR刺激的提睾肌中的中性粒细胞浸润,但这种作用在Atg5iΔEC小鼠中被废除,表明Tat-Beclin1对EC自噬诱导具有特异性的功效。Tat-Beclin1抑制中性粒细胞浸润到组织中与中性粒细胞在血管腔内的滞留增加一致,表明 EC自噬在中性粒细胞破坏EC中的调节作用。
该研究确定了EC自噬是白细胞破坏小静脉壁的非冗余负调节因子,这种机制可能防止急性白细胞介导的组织损伤,从而抑制潜在的慢性炎症的发生。在机制上,研究者将其与细胞表面粘附分子的调控和通过自噬机制重塑EC接触点相一致,结果表明,异常EC连接的形成,具有支持白细胞TEM的高能力,可能在自噬失调和众多炎症和衰老相关病理的发展之间发挥因果联系。(生物谷 bioon)
参考文献
Natalia Reglero-Real et al. Autophagy modulates endothelial junctions to restrain neutrophil diapedesis during inflammation. Immunity(2021 Aug 06) doi:https://doi.org/10.1016/j.immuni.2021.07.012
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。