PNAS: 在PINK1缺乏的情况下,神经酰胺积累诱导自噬并损害β氧化
来源:本站原创 2021-10-29 19:31
通过线粒体电子传递链(ETC)产生能量和线粒体自噬是影响Par- kinson病(PD)的两个重要过程。
通过线粒体电子传递链(ETC)产生能量和线粒体自噬是影响Par- kinson病(PD)的两个重要过程。有趣的是,引起早发PD的PINK1突变在这两个过程中都起着关键作用,表明这两种机制是相互关联的。然而,这两种途径的聚合联系目前仍是一个谜。最近的研究结果表明,在PD患者死后的大脑中存在脂质聚集和缺陷线粒体。
此外,越来越多的证据表明鞘磷脂,包括神经酰胺,在PD中发生改变,支持脂类在PD病理生理学中的重要性。在这里,作者发现神经酰胺在pink1相关的PD中发挥了关键作用,而pink1相关的PD之前几乎完全与线粒体功能障碍有关。作者发现神经酰胺在线粒体中积累,并对线粒体功能产生负面影响,最显著的是ETC。
图片来源:https://doi.org/10.1073/pnas.2025347118
PINK1功能缺失导致常染色体隐性遗传性早发性帕金森病。大多数患者表现为运动迟缓、僵硬、静止性震颤和运动障碍,对多巴胺替代疗法有反应。在细胞水平上,PINK1疾病突变导致能量代谢受损和多种线粒体缺陷,这些缺陷可以通过刺激能量代谢来部分缓解。有趣的是,最近在帕金森病患者死后大脑的路易小体中发现了异常的线粒体形态和脂质聚集体,挑战了以前认为α-突触核蛋白是几乎唯一的神经病理相关的概念。这一发现证实了线粒体功能障碍在帕金森病发病中的作用,并提出脂质在帕金森病发病机制中的重要作用。
PINK1对于复合物I亚基NdufA10的磷酸化非常重要,从而产生高效的复合物I和电子传递链(ETC)活性。这一功能在进化上在果蝇和人类之间是保守的。因此,在果蝇和人类中,PINK1的丢失都会导致ETC受损,ATP水平降低,线粒体形态缺陷,所有这些都在果蝇的早期幼虫阶段随处可见。此外,与Parkin一起,PINK1在线粒体自噬中起着至关重要的作用,以去除在年龄依赖性方式出现缺陷的线粒体。
PINK1突变的黑腹果蝇还表现出胸肌退化和飞行能力缺陷。这些缺陷,以及受损的线粒体形态,可以通过表达促分裂蛋白Drp1来修复。然而,增加裂变并不能改善与ETC相关的缺陷。此外,对ETC的刺激或促进可以挽救PINK1突变果蝇的ETC相关表型,包括ATP水平和线粒体形态。这些数据共同提出了两种平行的机制,它们汇聚在一条共同的路径上,导致帕金森病的发展。然而,这两条路径之间的联系还有待解决。
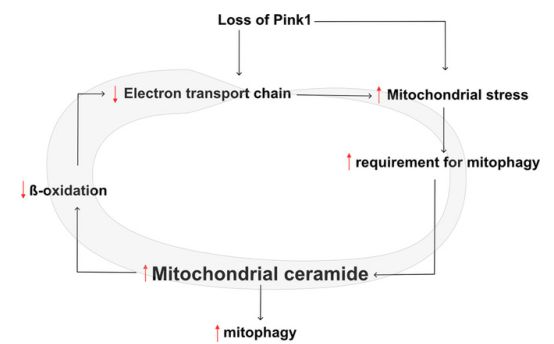
PINK1的丢失导致ETC缺陷,随后是线粒体应力增加
图片来源:https://doi.org/10.1073/pnas.2025347118
综上所述,作者提出了一种神经酰胺在线粒体中积累并启动线粒体自噬的机制,作为一种替代机制,以满足PINK1缺陷患者增加的线粒体清除需求。然而,神经酰胺积累伴随着β氧化降低等反作用,导致ETC功能下降,从而增强PINK1突变表型,进一步增加线粒体清除的必要性。在健康条件下,神经元主要通过葡萄糖代谢产生能量;然而,周围的细胞,如神经胶质细胞,只在大脑中进行β氧化。
正如在PINK1突变体中观察到的那样,当能量稳态被破坏时,胶质细胞在脑能量生产中起着核心作用。有趣的是,在激活的神经元中,脂质产生增加,在这些神经元中形成一种潜在的毒性危害,通过β-氧化降解,被邻近的胶质细胞清除。神经胶质细胞缺乏脂质摄取导致神经变性。作者的数据进一步证实了这些发现,因为神经酰胺积累导致的β-氧化降低有助于观察到的表型的严重程度,可以通过刺激PINK1缺乏的β-氧化来缓解。因此,作者提供额外的支持,以刺激β-氧化作为神经退行性变的治疗干预。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




