Cell:新研究揭示治疗囊性纤维化的校正剂药物的作用机制
来源:本站原创 2022-01-10 14:33
发生突变的囊性纤维化跨膜传导调节蛋白(CFTR)导致了一种损害肺部的称为囊性纤维化(cystic fibrosis)的遗传性疾病。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员解析出这种蛋白的结构以及某些药物如何与它结合,从而揭示了这些药物的作用方式。
2022年1月9日讯/生物谷BIOON/---发生突变的囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator, CFTR)导致了一种损害肺部的称为囊性纤维化(cystic fibrosis)的遗传性疾病。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员解析出这种蛋白的结构以及某些药物如何与它结合,从而揭示了这些药物的作用方式。相关研究结果发表在2022年1月6日的Cell期刊上,论文标题为“Mechanism of CFTR correction by type I folding correctors”。
就在十多年前,在现代医学的一项伟大进步中,Aurora Biosciences公司(下称Aurora公司)和后来的Vertex制药公司(下称Vertex公司)的研究人员大海捞针,发现了一种可以治疗囊性纤维化的小分子药物。
Vertex公司的第一种药物伊伐卡托(ivacaftor)于2012年获得批准,其他药物也相继问世,极大地提高了囊性纤维化患者的生存年龄和生活质量。这些药物改善了肺部功能,使患者能够更好地呼吸。科学家们知道,这些药物以某种方式调整或校正了导致这种疾病的错误蛋白,但它们是如何发挥作用的一直是未知数。
如今,在这项新的研究中,洛克菲勒大学的Jue Chen博士及其研究团队发现了这种突变蛋白的结构以及所谓的校正剂药物如何与之相互作用,从而揭示了这些分子是如何起作用的。她的团队报告说,它们在这种有缺陷的蛋白的生物生成过程中与之结合并使它保持稳定,让它有更好的机会成功到达细胞表面。
美国约翰霍普金斯大学医学院的医学遗传学家Garry Cutting(未参与这项研究)说,虽然许多科学家们已经在理解这些药物的作用机制方面取得了进展,但Chen的这项新研究 “是一个实质性的贡献---它对该领域具有突破性意义”。
Chen说,“令人满意的是,尽管这些药物是根据经验发现的,但它们通过基本的热力学原理发挥作用,这些原理是蛋白稳定性的基础。我也希望这些数据能够指导新疗法的开发,以帮助那些对当前疗法没有反应的人。”
害群之马
作为一种遗传性疾病,囊性纤维化可导致肺部损伤、消化系统问题和感染,以及其他医疗问题。它是由CFTR蛋白发生突变引起的。正常情况下,这种蛋白作为一种通道,允许氯离子等重要离子跨过细胞膜。当发生突变时,CFTR就会发生功能故障或几乎完全不存在,导致囊性纤维化患者的平均预期寿命只有30岁或更少。两种类型的药物,称为增效剂(potentiator)和校正剂(corrector),几乎使患者的平均预期寿命翻了一番。Cutting说,“叹为观止的是,这些药物能够解决全世界90%的患者的疾病根源,改善了许多患者的生命。”
但是,小分子如何校正这种突变蛋白造成的缺陷这一科学难题依然存在。Chen决定接受这一挑战。她之前成功地阐明了所谓的ABC转运蛋白---将糖等物质进行跨膜运输的蛋白---的分子机制。不过,她也一直在关注一种特别不寻常的转运蛋白---CFTR。她解释说,“它是蛋白家族中的害群之马,因为它在这个蛋白家族中唯一作为通道而不是作为泵发挥作用。”换句话说,CFTR不是主动地将物质从低浓度区域运送到高浓度区域,而是简单地让分子顺着浓度梯度流动,就像水往低处流一样。Chen说,“这使我对这种蛋白非常感兴趣。”
起初,弄清这种蛋白的结构以及这些药物可能结合的位置几乎是不可能的。原因在于即使没有发生突变,CFTR也是不稳定的,它的各个部分都会发生变化。作为解析蛋白结构的标准技术,X射线晶体衍射也不能胜任这一任务。X射线晶体衍射依赖于能够形成稳定晶体结构的蛋白---这对于发生变化的蛋白来说并不容易。Chen解释说,“你无法获得它的晶体,因为这种蛋白的一些部分会经常移动。”
图片来自Cell, 2022, doi:10.1016/j.cell.2021.12.009。
然而,这一障碍被2014年的一项技术突破---低温电镜---所扫除。通过冷冻待研究的蛋白样本,低温电镜允许获得蛋白详细结构的电镜图片。Chen首先使用该技术研究了CFTR的通道闭合和通道开放形式的结构,并于2016年和2017年分别发表在Cell期刊上。此后,她的团队发现,改善突变CFTR蛋白功能的囊性纤维化增效剂药物以一种保持通道开放的方式与这种蛋白结合,正如2019年他们在Science期刊上所报道的那样(Science, 2019, doi:10.1126/science.aaw7611)。
意料之外的空腔
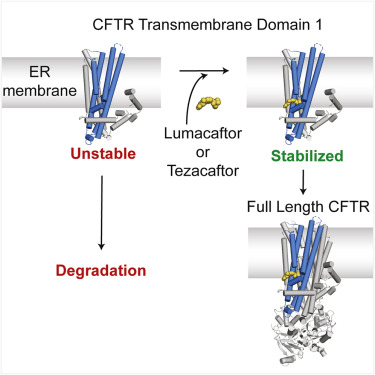
Chen和她的一名博士后助理Karol Fiedorczuk随后转向了另一种类型的药物,即那些改善CFTR突变蛋白折叠的药物。通过拍摄数以千计的电镜图片,他们发现CFTR在它的三维结构中有一个意想不到的空腔。这些校正剂药物精确地嵌在这个空腔里,稳定了这种蛋白并确保它折叠成正确的形状。Chen说,“直到你真正观察到它,你才会感到惊讶,因为在文献中还没有其他小分子如何协助蛋白折叠的例子。”
Fiedorczuk和Chen利用这种三维结构提出了这种蛋白的分子故障如何导致囊性纤维化,以及利用药物如何加以拯救。他们的想法集中在CFTR的稳定性上。
CFTR是一种大型的复杂蛋白,有五个不同的结构域。细胞需要两个小时来制造和正确折叠这种蛋白。Chen说,这意味着出现差错需要一段很长的时间。她的团队发现的这个空腔也无法提供帮助。它甚至存在于正常的CFTR蛋白中,使它们变得不稳定并容易降解。即使在最好的情况下,细胞产生的80%或更多的典型CFTR蛋白无法到达需要它的膜上。
导致囊性纤维化的CFTR突变使这一问题更加严重。这种遗传缺陷增加了这种蛋白的不稳定性,因此几乎没有一个蛋白最终到达需要它的地方,从而导致这种疾病。但通过在这个空腔中结合这种蛋白,校正剂药物稳定了细胞制造的这种蛋白的第一部分,使得它不被降解。这为细胞赢得了足够的时间来制造这种蛋白的其余部分并将它折叠成正确的形状。
Chen说,这些发现验证了30年前首次提出的一个想法,即这种蛋白中的空腔使它不稳定,不稳定性随着这种空腔的增大而增加。她说,“理性而言,这非常令人满意。更实际的是,它解释了为什么一种药物可以帮助具有不同突变的囊性纤维化患者。”
美国加州大学欧文分校生理学家和生物物理学家Stephen White说,仍有更多细节有待发现,比如药物在与这种蛋白结合之前停留在细胞中的位置,尽管如此,他仍然认为Chen的这项新研究是“一个重要的起点”。(生物谷 Bioon.com)
参考资料:
Karol Fiedorczuk et al. Mechanism of CFTR correction by type I folding correctors. Cell, 2022, doi:10.1016/j.cell.2021.12.009.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


