高磷血症新药!美国FDA拒绝批准NHE3抑制剂tenapanor控制肾脏病透析患者血清磷,复星医药引进中国!
来源:本站原创 2021-07-31 20:04
tenapanor是治疗高磷血症的一种首创药物,复星医药于2017年12月获得了中国独家授权。

慢性肾脏病-CKD(图片来源:kidneycarecentre.in)
2021年07月31日讯 /生物谷BIOON/ --Ardelyx公司致力于开发创新疗法改善肾脏和心肾疾病患者的治疗。该公司近日宣布,已收到美国食品和药物管理局(FDA)的一封完整回应函(CRL),该函涉及口服钠氢交换体3(NHE3)抑制剂tenapanor的新药申请(NDA),用于慢性肾脏病(CKD)透析成人患者控制血清磷水平(治疗高磷血症)。该NDA由一个涉及1000多名患者的综合开发项目支持,包括3个3期临床试验,所有这些试验均达到了主要和关键次要终点。
根据CRL,虽然FDA同意“提交的数据提供了大量证据,证明tenapanor能有效降低CKD透析患者的血清磷”,但将治疗效果的大小描述为“小且临床意义不明确”。此外,FDA指出,对于要批准的申请,Ardelyx需要“进行额外的充分和良好对照的试验,证明对血清磷的临床相关治疗效果,或对于在透析CKD患者中被认为是由高磷血症引起的临床结果的影响。”CRL中没有提及安全性、临床药理学/生物药剂学、CMC或非临床问题。
Ardelyx总裁兼首席执行官Mike Raab表示:“我们对FDA的这一信息以及它对患者及其治疗医生的意义感到难过。我们仍然相信,对于高磷患者,tenapanor是一种重要的、首创(first-in-class)治疗选择。我们不同意FDA对tenapanor在我们的研究中治疗效果临床相关性的主观评估,这些研究达到了经FDA同意的所有临床终点。在我们看来,在我们所有的临床研究中,使用tenapanor治疗产生的血清磷降低数据是有意义的,具有临床意义。我们将与该机构合作,解决所提出的问题,并尽可能找到一条快速前进的路径。”
美国博伊西肾脏和高血压研究所(Boise Kidney and Hypertension Institute)临床研究主任Arnold Silva博士表示:“降低血清磷是我管理透析患者的首要任务,也是由同行评审的全球公认KDIGO临床实践指南驱动的既定护理标准。多年的研究表明,即使血清磷略微升高,也会产生负面影响。尽管我们在目前可用的治疗方法上做出了最大努力,但血清磷的管理仍然是一个重大挑战。我们需要新的工具。我一直在密切关注tenapanor的广泛临床开发,不仅是作为一名感兴趣的肾脏病学家,也是一名临床研究者。我亲眼目睹了tenapanor对我的患者的临床益处,令我震惊的是,尽管大量的临床数据证明了它的安全性和有效性,FDA却没有批准这种新型机制药物。”
美国斯坦福大学肾脏科主任和医学教授Glenn Chertow表示:“无论是腹膜透析还是血液透析都不能提供足够的血清磷控制,必须使用药物。不幸的是,磷酸盐结合剂——单独或联合使用——很少能稳定控制血清磷水平,持续高磷血症会导致营养不良钙化、加速动脉硬化血管疾病、骨折和其他严重影响患者生活的并发症。在3期试验中观察到的tenapanor对血清磷的影响具有临床意义。tenapanor将使更多的患者达到目标血清磷浓度,并将为这一弱势群体带来显著的临床益处。”
tenapanor化学结构式(图片来源:pharmawiki.ch)
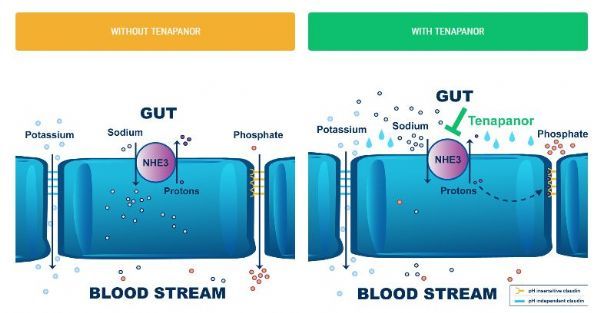
tenapanor由Ardelyx公司发现和开发,主要用于治疗便秘型肠易激综合征(IBS-C)和终末期肾脏病-血液透析(ESRD-HD)患者高磷血症。tenapanor是一种首创的(first-in-class)、专有的口服药物,具有独特的作用机制,在肠道局部发挥作用,抑制钠氢交换体3(NHE3)。NHE3是一种表达在小肠和结肠肠道上皮细胞顶端表面的逆向转运蛋白,通过交换质子(H+)吸收钠(Na+),主要负责膳食钠的吸收。
2017年12月,复星医药从Ardelyx获得了tenapanor在中国地区(包括中国大陆,香港和澳门特别行政区)的独家开发和商业化许可。2019年9月,tenapanor片IBS-C临床试验申请获得受理;2019年12月,tenapanor片高磷血症临床试验申请获得受理。
治疗IBS-C方面,tenapanor通过抑制肠道上皮细胞顶端表面的NHE3,减少了小肠和结肠对钠的吸收,导致进入肠腔的水分分泌增加,从而加快肠道蠕动并使粪便更加柔软疏松,使IBS-C患者排便增加、腹痛减轻。在动物模型中,tenapanor也被证明可以通过降低内脏高敏感性和降低肠道通透性来减轻腹痛。在结肠超敏大鼠模型中,tenapanor降低了内脏痛觉过敏(VHL)并使结肠感觉神经元兴奋性正常化。
在美国,2020年9月,tenapanor(商品名:Ibsrela,50mg片剂)获得FDA批准,该药每日口服2次,用于治疗IBS-C成人患者,增加排便、减轻腹痛。需要指出的是,在治疗IBS-C方面,Ibsrela药物标签中附有一则黑框警告:提示在儿科患者中有严重脱水的风险。该药禁止用于6岁以下的患者,在年幼大鼠中,tenapanor可导致死亡,推测是由于脱水所致。Ibsrela避免在6岁至12岁以下的患者中使用。Ibsrela在18岁以下儿科患者中的安全性和有效性尚未确定。
tenapanor作用机制(点击图片,查看大图)
治疗CKD透析患者高磷血症方面,由于NHE3的功能是交换质子(H+)吸收钠(Na+),tenapanor通过抑制肠道上皮细胞顶端表面的NHE3,增加细胞内的质子(H+),而增加的质子(H+)选择性地收紧细胞之间的连接,导致上皮细胞连接的构象变化,降低了特定于磷酸盐的透过性,导致通过细胞旁途径(paracellular pathway,膳食磷酸盐吸收的主要途径)的磷酸盐吸收减少,从而降低血清磷水平。细胞旁途径是指营养物质和水通过相邻上皮细胞之间的紧密连接进入细胞间隙、然后进入血液的途径。临床和临床前数据表明,tenapanor抑制NHE3,对大分子吸收途径没有影响。
Ardelyx公司已开展了3项3期临床试验,评估了tenapanor对CKD透析成人患者控制血清磷的疗效和安全性:(1)2项单药治疗试验——短期单药治疗3期BLOCK研究(n=219,12周),长期单药治疗3期PHREEDOM研究(n=423,52周);(2)1项双重机制试验——3期AMPLIFY研究(n=235,4周),评估tenapanor合用磷酸盐结合剂的双重机制疗法,并与单用磷酸盐结合剂进行对比。
所有3项3期试验均达到了主要终点和关键次要终点:tenapanor短期、长期、与磷酸盐结合剂合用均显著降低了血清磷水平。Ardelyx公司还正在进行一项NORMALIZE开放标签扩展研究(n=171),评估tenapanor单独使用或合用司维拉姆(sevelamer)达到正常磷水平(2.5–4.5 mg/dL)的能力。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->