Cell:揭示DNA修复蛋白RAD51可让CRISPR基因编辑更高效
来源:本站原创 2021-07-06 17:07
2021年7月6日讯/生物谷BIOON/---基因编辑是有目的地改变基因的DNA序列,是研究突变如何导致疾病,以及为治疗目的改变一个人的DNA的有力工具。在一项新的研究中,美国麻省理工学院大脑与认知科学教授Guoping Feng及其团队开发出一种可用于这两种目的的新型基因编辑方法。相关研究结果近期发表在Cell期刊上,论文标题为“Efficient emb
2021年7月6日讯/生物谷BIOON/---基因编辑是有目的地改变基因的DNA序列,是研究突变如何导致疾病,以及为治疗目的改变一个人的DNA的有力工具。在一项新的研究中,美国麻省理工学院大脑与认知科学教授Guoping Feng及其团队开发出一种可用于这两种目的的新型基因编辑方法。相关研究结果近期发表在Cell期刊上,论文标题为“Efficient embryonic homozygous gene conversion via RAD51-enhanced interhomolog repair”。

Feng说,“这一技术进步可以加速动物疾病模型的产生,至关重要的是,还为校正致病突变开辟了一种全新的方法。”
疾病的遗传模型
Feng实验室的一个主要目标是通过基因改造培育携带导致人类神经发育疾病和神经精神疾病的基因突变的动物模型,精确确定这些疾病的问题所在。新的模型可以通过给胚胎注射基因编辑工具和携带校正突变所需的DNA片段来产生。
在其中的一种方法中,基因编辑工具CRISPR经编程后切割靶基因,从而激活天然的DNA机制:利用注入的模板DNA“修复”受到破坏的靶基因。然后,经过CRISPR改造的细胞能够将这种基因变化传递给后代,从而构建出一种稳定的用于测试疾病和疗法的遗传谱系。
尽管CRISPR加快了产生此类疾病模型的过程,但这一过程仍然可能需要数月或数年。效率低下的原因是许多经过处理的细胞根本没有发生所需的DNA序列变化,而且这种变化只发生在两个基因拷贝中的一个(对于大多数基因,每个细胞包含两个拷贝,一个来自父本,一个来自母本)。
为了提高基因编辑过程的效率,Feng实验室最初假设,在CRISPR基因编辑工具的标准混合物中加入一种名为RAD51的DNA修复蛋白,将增加细胞(在这种情况下是受精小鼠卵,即单细胞胚胎)发生所需基因变化的几率。
作为一个测试案例,他们测量了他们能够插入(“敲入”)与自闭症有关的基因Chd2突变的速率。被正确编辑的胚胎的总体比例保持不变,但令他们惊讶的是,在两条染色体上携带所需基因编辑的比例明显更高。用一个不同的基因进行的测试也产生了同样的意外结果。
论文共同第一作者Jonathan Wilde解释说,“同时编辑两条染色体通常是非常不常见的。在使用RAD51的情形下观察到的高编辑率确实令人震惊,而且开始时只是简单地尝试制造Chd2突变小鼠,但很快就变成了一个更大的项目,旨在专注于RAD51及其在基因组编辑中的应用。”
分子复制机器
Feng实验室接下来着手了解RAD51增强基因编辑的机制。他们假设RAD51参与了一种叫做同源体间修复(interhomolog repair, IHR)的过程,即一条染色体上的DNA断裂以该染色体的第二个拷贝(来自另一个亲本)为模板进行修复。
为了测试这一点,他们给小鼠胚胎注射了RAD51和CRISPR,但没有注射模板DNA。他们对CRISPR进行编程,只切割其中一条染色体上的基因序列,然后测试它是否被修复以匹配未切割染色体拷贝上的序列。在这个实验中,他们不得不使用母体和父体染色体上的序列不同的小鼠。
他们发现,单独注射CRISPR的对照组胚胎很少出现IHR修复。然而,添加RAD51显著增加了编辑CRISPR靶向基因以匹配未切割染色体拷贝的胚胎数量。
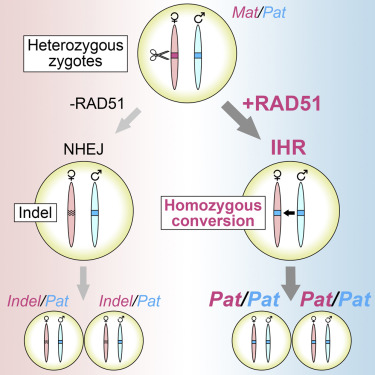
图片来自Cell, 2021, doi:10.1016/j.cell.2021.04.035。
Wilde说,“以前对IHR的研究已发现,它在大多数细胞中的效率低得惊人。我们发现它在胚胎细胞中更容易发生,并且可以被RAD51增强,这表明更深入地了解是什么使胚胎允许这种类型的DNA修复,可能帮助我们设计更安全和更有效的基因疗法。”
校正致病突变的新方法
标准的基因治疗策略依赖于注射一种校正性的DNA片段,作为修复突变的模板,而且这种突变修复是通过一种叫做同源定向修复(homology-directed repair, HDR)的过程进行的。
Feng解释说,“基于HDR的策略仍然存在效率低下的问题,并且存在供体DNA在整个基因组中不必要的整合风险。IHR有可能克服这些问题,因为它依靠自然的细胞途径和患者自身的正常染色体来校正有害的突变。”
Feng团队接着鉴定出能够刺激IHR的其他DNA修复相关蛋白,包括几种不仅能促进高水平IHR而且也能抑制DNA修复过程中出现差错的蛋白。允许该团队检查IHR事件的基因组特征的其他实验使人们对IHR的机制有了更深入的了解,并提出了该技术可用于使基因疗法更安全的方法。
论文共同第一作者Tomomi Aida说,“虽然对IHR的这种新应用仍有许多需要了解的地方,但我们的发现是一种新的基因治疗方法的基础,它可能帮助解决目前方法的一些重大问题。”(生物谷 Bioon.com)
参考资料:
Jonathan J. Wilde et al. Efficient embryonic homozygous gene conversion via RAD51-enhanced interhomolog repair. Cell, 2021, doi:10.1016/j.cell.2021.04.035.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


