2020年5月Science期刊不得不看的亮点研究
来源:本站原创 2020-05-31 23:42
2020年5月31日讯/生物谷BIOON/---2020年5月份即将结束了,5月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:开发出利用人工蛋白设计疫苗策略doi:10.1126/science.aay5051在一项新的研究中,瑞士洛桑联邦理工学院蛋白设计与免疫工程实验室的Bruno Correia教授及
2020年5月31日讯/生物谷BIOON/---2020年5月份即将结束了,5月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.两篇Science论文指出在恒河猴中,DNA疫苗可预防SARS-CoV-2感染,而且之前的感染可预防再次感染
doi:10.1126/science.abc6284; doi:10.1126/science.abc4776
全球有近500万例确诊病例,有30多万人死于COVID-19,但对导致这种疾病的SARS-CoV-2病毒仍有许多未知数。两个关键问题是疫苗是否能够预防新型冠状病毒SARS-CoV-2感染,以及已经从COVID-19中恢复过来的人是否能够避免再次感染。由美国贝斯以色列女执事医疗中心(BIDMC)的研究人员领导的两项新的研究为解答这些问题提供了新的启示。相关研究结果于2020年5月20日在线发表在Science期刊上,论文标题分别为“DNA vaccine protection against SARS-CoV-2 in rhesus macaques”和“SARS-CoV-2 infection protects against rechallenge in rhesus macaques”。

在第一项研究中,这些研究人员证实六种候选DNA疫苗在恒河猴中诱导出中和抗体反应,并可预防它们感染SARS-CoV-2。Barouch及其同事们在1月中旬中国科学家发布病毒基因组时,就开始研制COVID-19疫苗,开发了一系列表达刺突蛋白变体的候选DNA疫苗,其中,刺突蛋白是新型冠状病毒SARS-CoV-2的关键抗体靶点。这些疫苗旨在训练人体的免疫系统在接触病毒后迅速识别它并作出反应。
为了评估这些疫苗的疗效,这些研究人员对25只成年恒河猴进行了研究性DNA疫苗免疫接种,另外10只恒河猴接受了模拟对照(sham control)接种。接种过疫苗的恒河猴产生了抗病毒的中和抗体。在加强疫苗接种三周后,所有35只恒河猴都暴露于病毒中。随访测试显示,与对照组相比,接种疫苗的恒河猴的病毒载量显著降低。在25只接种疫苗的恒河猴中,有8只恒河猴在暴露于病毒中后的任何一个时间点上都没有表现出可检测到的病毒,剩下的17只具有较低的病毒水平。此外,较高的抗体水平与较低的病毒载量有关,这表明中和抗体可能作为保护的一个相关因素,并可能被证明是临床测试SARS-CoV-2疫苗的一个基准。
在第二项研究中,这些研究人员证实,从COVID-19中恢复的恒河猴会产生天然的保护性免疫力,防止再次感染。Barouch说,“从许多病毒感染中恢复过来的个体通常会产生抗体,这些抗体可以防止再次感染,但并不是所有的病毒感染都会产生这种天然的保护性免疫力。”
这些研究人员将9只成年恒河猴暴露于SARS-CoV-2病毒中后,随着这些恒河猴的恢复,对它们的病毒水平进行了监测。这9只动物都恢复了,并产生了抗病毒的抗体。在初次感染后一个多月后,他们让这些恒河猴再次暴露在病毒中。在第二次暴露后,它们近乎完全预防这种病毒的再次感染。这些数据表明这种动物模型在初次感染后对COVID-19具有天然的保护性免疫力。
2.Science:开发出利用人工蛋白设计疫苗策略
doi:10.1126/science.aay5051
在一项新的研究中,瑞士洛桑联邦理工学院蛋白设计与免疫工程实验室的Bruno Correia教授及其团队如今开发出一种设计人工蛋白的策略,所设计出的人工干白可以非常精确地指导身体的免疫系统产生哪些抗体。相关研究结果在2020年5月15日的Science期刊上,论文标 题为“De novo protein design enables the precise induction of RSV-neutralizing antibodies”。
Correia团队用计算方法设构建出人工蛋白。论文共同第一作者Che Yang说,“它们在自然界中是不存在的。” 论文共同第一作者Fabian Sesterhenn说,“我们开发出一种名为TopoBuilder的蛋白设计算法。它可以让你几乎像把乐高积木拼接在一起那样构建蛋白。组装 具有新功能的人工蛋白绝对是非常迷人的。”
Correia团队专注于从头设计能够产生呼吸道合胞病毒(RSV)疫苗的蛋白。RSV会导致严重的肺部感染,是导致婴儿和老年人住院的主要原因之一。Correia说,“尽管经过数十年的研究,直到今天,仍然没有针对呼吸道合胞病毒的疫苗或治愈方法。”
这些人工蛋白是在实验室中构建的,然后在动物模型中测试,并触发免疫系统产生针对RSV弱点的特异性抗体。Correia说,“我们的发现是令人鼓舞的,这是因为它们表明,有朝一日我们将能够促使免疫系统产生这些特定的抗体,从而更有效地设计出针对特定病毒的疫 苗。要使我们开发的疫苗更有效,我们还有很多的研究工作要做---这项研究是朝着这个方向迈出的第一步。”
3.两篇Science论文揭示疟原虫也有自己的内部时钟,用于协调对宿主细胞的破坏
doi:10.1126/science.aba2658; doi:10.1126/science.aba4357
疟疾感染期间,无数疟原虫同时破坏它们所栖息的红细胞。这种破坏会在感染者体内每隔24小时、48小时或72小时就会引起一波发烧和发冷,这取决于哪种疟原虫虫株引起的感染。多年来,科学家们一直假设宿主的生物节律负责对疟原虫活动的协调和计时。不过,在两 项新的研究中,研究人员发现疟原虫有它们自己的内部时钟(或者说固有时钟),从而既能对宿主做出反应,又能自行振荡。
在第一项研究中,Rijo-Ferreira及其同事们用夏氏疟原虫(Plasmodium chabaudi)感染小鼠,其中夏氏疟原虫感染导致小鼠患上疟疾。他们发现无论是让小鼠长期处于黑暗中,还是改变它们的进食节律,都不会扰乱夏氏疟原虫强大的细胞周期和基因表达节律。当 Rijo-Ferreira团队让夏氏疟原虫感染经过基因改造后具有26小时而不是24小时昼夜节律的小鼠时,这种疟原虫将它们的无性生活周期延长到26小时,而不是典型的24小时,这表明它们是灵活的,对宿主的振荡有反应。
在这一点上,Rijo-Ferreira团队预测,如果这种疟原虫没有内在时钟,它们会在没有明确节律的宿主中很快就变得不同步。但当他们用夏氏疟原虫感染经过基因改造后缺乏昼夜节律的小鼠时,这种疟原虫在5到7天内保持了24小时的细胞周期和基因表达节律,这表明它们 确实有一种内部时钟。鉴于这种疟原虫的内部时钟最终失去了同步性,他们得出结论,它的内部时钟节律依赖于宿主的协调。
在第二项研究中,美国杜克大学生物学家Steven Haase领导的一个研究团队发现当在人血中培养时,四种导致人类患上疟疾的疟原虫虫株在基因表达和细胞周期活动方面也表现出内在振荡。虽然在体外培养的疟原虫比小鼠体内的疟原虫更快地失去同步性,但是在两天的 时间窗口里,它们可以保持自己的节律,这与其他已经被证明拥有昼夜节律的培养系统是相类似的。
4.Science:气候的局部变化不太可能导致早期的COVID-19大流行
doi:10.1126/science.abc2535
在一项新的研究中,来自美国普林斯顿大学的研究人员发现气候的局部变化不太可能主导COVID-19的第一波疫情。他们发现大量的人仍然容易受到导致COVID-19疫情的新型冠状病毒SARS-CoV-2毒株的影响,而且这种病原体的传播速度意味着气候条件只可能对目前的感染率产生影响。相关研究结果于2020年5月18日在线发表在Science期刊上,论文标题为“Susceptible supply limits the role of climate in the early SARS-CoV-2 pandemic”。
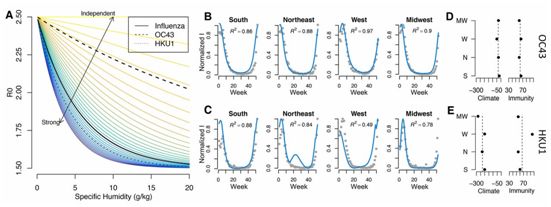
论文第一作者兼论文通讯作者、普林斯顿大学普林斯顿环境研究所博士后研究助理Rachel Baker说,“我们预测更温暖或更潮湿的气候不会在COVID-19疫情的早期阶段减缓这种病毒的传播速度。我们确实观察到气候对COVID-19疫情的规模和时间有一定的影响,但是总地来说,由于人群中有如此多人存在易感性,无论气候条件如何,这种病毒都会迅速传播。”
Baker说,这种病毒在巴西、厄瓜多尔、澳大利亚和其他热带和南半球国家的迅速传播---这种病毒在夏季开始流行的地方---表明较暖的环境确实无助于阻止COVID-19疫情。
5.全文编译!我国科学家发表Science论文,发现两种非竞争性人类中和抗体可阻断SARS-CoV-2病毒结合人ACE2受体
doi:10.1126/science.abc2241
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
6.Science:抗癌药物伊利司莫有望治疗门克斯病等铜缺乏症
doi:10.1126/science.aaz8899; doi:10.1126/science.abb6662
门克斯病是一种罕见的遗传性疾病,大约每5万~30万名新生儿中就有1名患此病。患有这种疾病的幼儿通常在出生后3年内死亡,死亡原因是基因突变限制了他们的身体从饮食中吸收和利用铜的能力。铜缺乏会导致严重的脑损伤和神经肌肉功能障碍。
在一项新的研究中,美国德克萨斯农工大学生物化学与生物物理学系教授James Sacchettini博士和生物化学与生物物理学系助理教授Vishal Gohil博士领导的一个研究团队概述了他们的最新发现:使用抗癌药物伊利司莫(elesclomol)有望治疗门克斯病(Menkes disease)中的铜缺乏。这一发现为铜缺乏症患者(特别是被诊断为门克斯病的幼儿患者)带来了一个好消息。相关研究结果发表在2020年5月8日的Science期刊上,论文标题为“Elesclomol alleviates Menkes pathology and mortality by escorting Cu to cuproenzymes in mice”。
Sacchettini说,“实验性疗法并不能有效地克服这种疾病的最严重症状或早期死亡率。”Gohil说,“我们当前的研究记录了在门克斯病小鼠模型中使用伊利司莫的疗效,这使得我们离临床试验又近了一步。”
7.Science:重大进展!构建出人造叶绿体,比自然界的光合作用更高效!
doi:10.1126/science.aaz6802; doi:10.1126/science.abc1226
经过几十亿年的时间,微生物和植物进化出了一种非凡过程,即我们所知道的光合作用。光合作用将太阳的能量转化为化学能,从而为地球上的所有生命提供食物和氧气。作为产生光合作用的细胞区室,叶绿体可能是地球上最重要的自然引擎。许多科学家认为人工重建和控制光合作用过程 是 "我们这个时代的阿波罗计划"。这将意味着有能力生产出清洁能源---清洁燃料、清洁碳化合物(如抗生素),以及其他仅靠光和二氧化碳就能产生的产品。
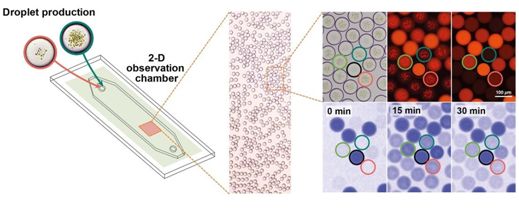
但如何从头开始建造一个有生命的光合细胞?模拟活细胞的光合过程的关键是让它的各个组成部分在合适的时间和地点共同发挥作用。在德国马普学会,这个雄心勃勃的目标是在一个跨学科的多实验室计划--MaxSynBio网络---中实现的。现如今,由Tobias Erb主任领导的一个研究团队已经成功地创建了一种平台,用于自动构建细胞大小的光合作用区室---人造叶绿体(artificial chloroplast),所构建出的人造叶绿体可以用光来捕捉和转化温室气体二氧化碳。相关研究结果发表在2020年5月8日的Science期刊上,论文标题为“Light-powered CO2 fixation in a chloroplast mimic with natural and synthetic parts”。
8.Science:新研究表明COVID症状追踪应用程序在应对病毒疫情中大有可为
doi:10.1126/science.abc0473
在一项新的研究中,一个在大数据研究和流行病学方面有专长的科学家联盟开发出一款COVID症状追踪应用程序(App),旨在快速收集信息,帮助应对正在发生的COVID-19大流行病。在美国和美国,有250万多人较早地使用了这款app,这为医生、科学家和政府官员提供了关于COVID-19的宝贵数据,以便更好地抗击病毒疫情。相关研究结果于2020年5月5日在线发表在Science期刊上,论文标题为“Rapid implementation of mobile technology for real-time epidemiology of COVID-19”。
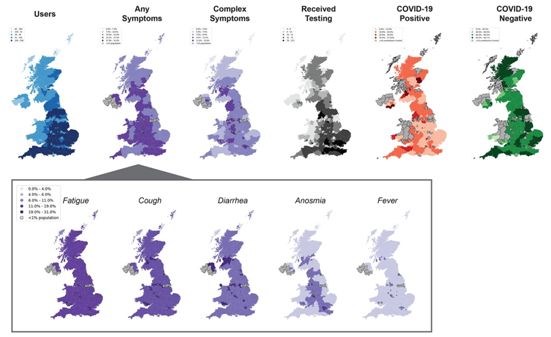
论文通讯作者、麻省总医院(MGH)癌症中心癌症流行病学主任Andrew T. Chan博士说,“这款App每天都会收集社区中的个人信息,包括他们是否感觉良好,如果不舒服,他们的具体症状是什么,以及他们是否接受过COVID-19检测。”这款app旨在深入了解关于COVID-19的热点地区在哪里以及需要注意的新症状,它可能作为一种有用的规划工具,为自我隔离提供指导方针方面的信息,确定需要增加呼吸机和扩大医院容量的地区,并提供实时数据,为未来的疫情爆发做好准备。
这款称为COVID症状追踪应用程序(COVID Symptom Tracker)的app于3月24日在英国推出,3月29日在美国上市。自推出以来,已经有超过300万人使用过它。
9.Science揭示衰老新机制!免疫细胞缺陷导致我们衰老!
doi:10.1126/science.aax0860
T细胞本应保护我们免受病原体的侵害,但一项新的小鼠研究表明,它们也可能加速衰老。阻断由细胞引起的炎症或增加关键代谢分子的供应,可以减轻啮齿动物衰老相关症状的严重程度,增加了这些治疗可能对老年人有益的可能性。相关研究成果于近日发表在Science上,该研究题为"T cells with dysfunctional mitochondria induce multimorbidity and premature senescence"。
澳大利亚RMIT大学的免疫学家Kylie Quinn说,这一发现是"一个神奇的结果,它直接将新陈代谢、炎症和衰老联系起来。他们做了一项非常彻底的工作,以确保是T细胞导致老鼠迅速衰老。"
随着年龄的增长,我们的T细胞会让我们失望,成为更弱的病原体斗士。这种下降有助于解释为什么老年人更容易受到感染,而对疫苗的反应较差。随着年龄的增长,T细胞会出现衰退,原因之一是细胞内作为动力装置的线粒体开始失灵。
10.Science:意外!运动竟然可以通过细胞因子促进耐力!
doi:10.1126/science.aat3987; doi:10.1126/science.abb4116
白细胞介素-13 (IL-13)是一种由T细胞、固有淋巴细胞(ILC2s)和粒细胞分泌的细胞因子。它在过敏和抗寄生虫防御中起着重要的中介作用,具有多种作用。5月1日,来自哈佛大学陈曾熙公共卫生学院、德克萨斯大学麦戈文医学院等单位的Knudsen等人在Science上发文报道了IL-13在运动和代谢中的独特作用。该研究表明接受耐力训练的小鼠血液中IL-13含量增加,这与ILC2在肌肉中的扩张有关。相比之下,当小鼠缺乏IL-13时,运动无法导致肌肉脂肪酸利用和线粒体生物生成的增加。肌肉IL-13受体下游信号通路的激活是这一作用的关键。肌内注射腺病毒IL-13可再现运动诱导的代谢重编程过程。这一信号通路可能是为了对抗寄生虫感染的代谢压力而进化的。
实际上早在20世纪60年代初,人们就已经发现不稳定的血液和淋巴因子可以调节运动对新陈代谢的影响。最近的研究进一步支持这样一种观点,即宿主免疫细胞与其宿主组织之间的交流对于调节代谢阈值从而维持组织功能非常重要。Knudsen等人发现耐力运动增加了小鼠和人类血液中白细胞介素-13 (IL-13)的循环水平。耐力运动还导致2型固有淋巴细胞(ILC2s)的扩增,ILC2s是小鼠肌肉中产生IL -13的主要细胞类型之一。这暗示了IL-13在运动引起的适应性反应控制中的作用。研究人员使用了几种分子和生物能量分析,并生成了三个遗传模型,以确定IL-13信号在骨骼肌肉对耐力运动训练的代谢重编程中的作用。
与野生型对照动物相比,IL-13缺陷小鼠在跑步机上的跑步能力下降。研究人员对对照组和IL-13缺陷小鼠的骨骼肌进行了RNA测序,以检测IL-13在运动生理学中的作用。结果表明IL-13对静止肌肉代谢基因表达无明显影响。然而,耐力训练增加了对照组动物肌肉中线粒体和脂肪酸氧化基因的网络信号,而缺乏IL- 13的小鼠则丢失了这些基因。IL-13缺乏的肌肉在一次运动后表现出脂肪酸利用缺陷,在耐力训练后未能增加线粒体的生物发生过程。此外,对照组动物的耐力训练导致肌肉氧化纤维数量的增加和线粒体呼吸、耐力和葡萄糖耐量的改善。所有这些运动训练的代谢益处都需要完整的IL-13信号。
Knudsen等人发现,IL-13通过其受体IL-13Rα1直接作用于骨骼肌,导致Stat3的激活。在单次训练和耐力训练后,肌肉中Stat3磷酸化水平升高,而IL-13缺陷小鼠体内的这种效应消失了。研究人员发现在C2C12肌小管中,IL-13处理增加了依赖于IL-13Ra1和Stat3的线粒体呼吸。IL-13-Stat3轴控制代谢程序通过协调与两个核受体和转录调控线粒体调节因子ERRα和ERRγ引起运动训练的改变和调控。在骨骼肌中特别缺乏IL-13Ra1或Stat3的小鼠,其肌肉脂肪酸氧化能力和耐力下降。相比之下,骨骼肌中IL-13水平的升高则以Stat3依赖的方式再现了耐力运动诱导的代谢重编程,从而改善了全身葡萄糖稳态和跑步能力。(生物谷 Bioon.com)
1.两篇Science论文指出在恒河猴中,DNA疫苗可预防SARS-CoV-2感染,而且之前的感染可预防再次感染
doi:10.1126/science.abc6284; doi:10.1126/science.abc4776
全球有近500万例确诊病例,有30多万人死于COVID-19,但对导致这种疾病的SARS-CoV-2病毒仍有许多未知数。两个关键问题是疫苗是否能够预防新型冠状病毒SARS-CoV-2感染,以及已经从COVID-19中恢复过来的人是否能够避免再次感染。由美国贝斯以色列女执事医疗中心(BIDMC)的研究人员领导的两项新的研究为解答这些问题提供了新的启示。相关研究结果于2020年5月20日在线发表在Science期刊上,论文标题分别为“DNA vaccine protection against SARS-CoV-2 in rhesus macaques”和“SARS-CoV-2 infection protects against rechallenge in rhesus macaques”。

图片来自Science, Published on 20 May 2020, doi:10.1126/science.abc6284。
在第一项研究中,这些研究人员证实六种候选DNA疫苗在恒河猴中诱导出中和抗体反应,并可预防它们感染SARS-CoV-2。Barouch及其同事们在1月中旬中国科学家发布病毒基因组时,就开始研制COVID-19疫苗,开发了一系列表达刺突蛋白变体的候选DNA疫苗,其中,刺突蛋白是新型冠状病毒SARS-CoV-2的关键抗体靶点。这些疫苗旨在训练人体的免疫系统在接触病毒后迅速识别它并作出反应。
为了评估这些疫苗的疗效,这些研究人员对25只成年恒河猴进行了研究性DNA疫苗免疫接种,另外10只恒河猴接受了模拟对照(sham control)接种。接种过疫苗的恒河猴产生了抗病毒的中和抗体。在加强疫苗接种三周后,所有35只恒河猴都暴露于病毒中。随访测试显示,与对照组相比,接种疫苗的恒河猴的病毒载量显著降低。在25只接种疫苗的恒河猴中,有8只恒河猴在暴露于病毒中后的任何一个时间点上都没有表现出可检测到的病毒,剩下的17只具有较低的病毒水平。此外,较高的抗体水平与较低的病毒载量有关,这表明中和抗体可能作为保护的一个相关因素,并可能被证明是临床测试SARS-CoV-2疫苗的一个基准。
在第二项研究中,这些研究人员证实,从COVID-19中恢复的恒河猴会产生天然的保护性免疫力,防止再次感染。Barouch说,“从许多病毒感染中恢复过来的个体通常会产生抗体,这些抗体可以防止再次感染,但并不是所有的病毒感染都会产生这种天然的保护性免疫力。”
这些研究人员将9只成年恒河猴暴露于SARS-CoV-2病毒中后,随着这些恒河猴的恢复,对它们的病毒水平进行了监测。这9只动物都恢复了,并产生了抗病毒的抗体。在初次感染后一个多月后,他们让这些恒河猴再次暴露在病毒中。在第二次暴露后,它们近乎完全预防这种病毒的再次感染。这些数据表明这种动物模型在初次感染后对COVID-19具有天然的保护性免疫力。
2.Science:开发出利用人工蛋白设计疫苗策略
doi:10.1126/science.aay5051
在一项新的研究中,瑞士洛桑联邦理工学院蛋白设计与免疫工程实验室的Bruno Correia教授及其团队如今开发出一种设计人工蛋白的策略,所设计出的人工干白可以非常精确地指导身体的免疫系统产生哪些抗体。相关研究结果在2020年5月15日的Science期刊上,论文标 题为“De novo protein design enables the precise induction of RSV-neutralizing antibodies”。
Correia团队用计算方法设构建出人工蛋白。论文共同第一作者Che Yang说,“它们在自然界中是不存在的。” 论文共同第一作者Fabian Sesterhenn说,“我们开发出一种名为TopoBuilder的蛋白设计算法。它可以让你几乎像把乐高积木拼接在一起那样构建蛋白。组装 具有新功能的人工蛋白绝对是非常迷人的。”
Correia团队专注于从头设计能够产生呼吸道合胞病毒(RSV)疫苗的蛋白。RSV会导致严重的肺部感染,是导致婴儿和老年人住院的主要原因之一。Correia说,“尽管经过数十年的研究,直到今天,仍然没有针对呼吸道合胞病毒的疫苗或治愈方法。”
这些人工蛋白是在实验室中构建的,然后在动物模型中测试,并触发免疫系统产生针对RSV弱点的特异性抗体。Correia说,“我们的发现是令人鼓舞的,这是因为它们表明,有朝一日我们将能够促使免疫系统产生这些特定的抗体,从而更有效地设计出针对特定病毒的疫 苗。要使我们开发的疫苗更有效,我们还有很多的研究工作要做---这项研究是朝着这个方向迈出的第一步。”
3.两篇Science论文揭示疟原虫也有自己的内部时钟,用于协调对宿主细胞的破坏
doi:10.1126/science.aba2658; doi:10.1126/science.aba4357
疟疾感染期间,无数疟原虫同时破坏它们所栖息的红细胞。这种破坏会在感染者体内每隔24小时、48小时或72小时就会引起一波发烧和发冷,这取决于哪种疟原虫虫株引起的感染。多年来,科学家们一直假设宿主的生物节律负责对疟原虫活动的协调和计时。不过,在两 项新的研究中,研究人员发现疟原虫有它们自己的内部时钟(或者说固有时钟),从而既能对宿主做出反应,又能自行振荡。
在第一项研究中,Rijo-Ferreira及其同事们用夏氏疟原虫(Plasmodium chabaudi)感染小鼠,其中夏氏疟原虫感染导致小鼠患上疟疾。他们发现无论是让小鼠长期处于黑暗中,还是改变它们的进食节律,都不会扰乱夏氏疟原虫强大的细胞周期和基因表达节律。当 Rijo-Ferreira团队让夏氏疟原虫感染经过基因改造后具有26小时而不是24小时昼夜节律的小鼠时,这种疟原虫将它们的无性生活周期延长到26小时,而不是典型的24小时,这表明它们是灵活的,对宿主的振荡有反应。
在这一点上,Rijo-Ferreira团队预测,如果这种疟原虫没有内在时钟,它们会在没有明确节律的宿主中很快就变得不同步。但当他们用夏氏疟原虫感染经过基因改造后缺乏昼夜节律的小鼠时,这种疟原虫在5到7天内保持了24小时的细胞周期和基因表达节律,这表明它们 确实有一种内部时钟。鉴于这种疟原虫的内部时钟最终失去了同步性,他们得出结论,它的内部时钟节律依赖于宿主的协调。
在第二项研究中,美国杜克大学生物学家Steven Haase领导的一个研究团队发现当在人血中培养时,四种导致人类患上疟疾的疟原虫虫株在基因表达和细胞周期活动方面也表现出内在振荡。虽然在体外培养的疟原虫比小鼠体内的疟原虫更快地失去同步性,但是在两天的 时间窗口里,它们可以保持自己的节律,这与其他已经被证明拥有昼夜节律的培养系统是相类似的。
4.Science:气候的局部变化不太可能导致早期的COVID-19大流行
doi:10.1126/science.abc2535
在一项新的研究中,来自美国普林斯顿大学的研究人员发现气候的局部变化不太可能主导COVID-19的第一波疫情。他们发现大量的人仍然容易受到导致COVID-19疫情的新型冠状病毒SARS-CoV-2毒株的影响,而且这种病原体的传播速度意味着气候条件只可能对目前的感染率产生影响。相关研究结果于2020年5月18日在线发表在Science期刊上,论文标题为“Susceptible supply limits the role of climate in the early SARS-CoV-2 pandemic”。

图片来自Science, 2020, doi:10.1126/science.abc2535。
论文第一作者兼论文通讯作者、普林斯顿大学普林斯顿环境研究所博士后研究助理Rachel Baker说,“我们预测更温暖或更潮湿的气候不会在COVID-19疫情的早期阶段减缓这种病毒的传播速度。我们确实观察到气候对COVID-19疫情的规模和时间有一定的影响,但是总地来说,由于人群中有如此多人存在易感性,无论气候条件如何,这种病毒都会迅速传播。”
Baker说,这种病毒在巴西、厄瓜多尔、澳大利亚和其他热带和南半球国家的迅速传播---这种病毒在夏季开始流行的地方---表明较暖的环境确实无助于阻止COVID-19疫情。
5.全文编译!我国科学家发表Science论文,发现两种非竞争性人类中和抗体可阻断SARS-CoV-2病毒结合人ACE2受体
doi:10.1126/science.abc2241
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
6.Science:抗癌药物伊利司莫有望治疗门克斯病等铜缺乏症
doi:10.1126/science.aaz8899; doi:10.1126/science.abb6662
门克斯病是一种罕见的遗传性疾病,大约每5万~30万名新生儿中就有1名患此病。患有这种疾病的幼儿通常在出生后3年内死亡,死亡原因是基因突变限制了他们的身体从饮食中吸收和利用铜的能力。铜缺乏会导致严重的脑损伤和神经肌肉功能障碍。
在一项新的研究中,美国德克萨斯农工大学生物化学与生物物理学系教授James Sacchettini博士和生物化学与生物物理学系助理教授Vishal Gohil博士领导的一个研究团队概述了他们的最新发现:使用抗癌药物伊利司莫(elesclomol)有望治疗门克斯病(Menkes disease)中的铜缺乏。这一发现为铜缺乏症患者(特别是被诊断为门克斯病的幼儿患者)带来了一个好消息。相关研究结果发表在2020年5月8日的Science期刊上,论文标题为“Elesclomol alleviates Menkes pathology and mortality by escorting Cu to cuproenzymes in mice”。
Sacchettini说,“实验性疗法并不能有效地克服这种疾病的最严重症状或早期死亡率。”Gohil说,“我们当前的研究记录了在门克斯病小鼠模型中使用伊利司莫的疗效,这使得我们离临床试验又近了一步。”
7.Science:重大进展!构建出人造叶绿体,比自然界的光合作用更高效!
doi:10.1126/science.aaz6802; doi:10.1126/science.abc1226
经过几十亿年的时间,微生物和植物进化出了一种非凡过程,即我们所知道的光合作用。光合作用将太阳的能量转化为化学能,从而为地球上的所有生命提供食物和氧气。作为产生光合作用的细胞区室,叶绿体可能是地球上最重要的自然引擎。许多科学家认为人工重建和控制光合作用过程 是 "我们这个时代的阿波罗计划"。这将意味着有能力生产出清洁能源---清洁燃料、清洁碳化合物(如抗生素),以及其他仅靠光和二氧化碳就能产生的产品。

图片来自Planck Institute for terrestrial Microbiology/Erb。
但如何从头开始建造一个有生命的光合细胞?模拟活细胞的光合过程的关键是让它的各个组成部分在合适的时间和地点共同发挥作用。在德国马普学会,这个雄心勃勃的目标是在一个跨学科的多实验室计划--MaxSynBio网络---中实现的。现如今,由Tobias Erb主任领导的一个研究团队已经成功地创建了一种平台,用于自动构建细胞大小的光合作用区室---人造叶绿体(artificial chloroplast),所构建出的人造叶绿体可以用光来捕捉和转化温室气体二氧化碳。相关研究结果发表在2020年5月8日的Science期刊上,论文标题为“Light-powered CO2 fixation in a chloroplast mimic with natural and synthetic parts”。
8.Science:新研究表明COVID症状追踪应用程序在应对病毒疫情中大有可为
doi:10.1126/science.abc0473
在一项新的研究中,一个在大数据研究和流行病学方面有专长的科学家联盟开发出一款COVID症状追踪应用程序(App),旨在快速收集信息,帮助应对正在发生的COVID-19大流行病。在美国和美国,有250万多人较早地使用了这款app,这为医生、科学家和政府官员提供了关于COVID-19的宝贵数据,以便更好地抗击病毒疫情。相关研究结果于2020年5月5日在线发表在Science期刊上,论文标题为“Rapid implementation of mobile technology for real-time epidemiology of COVID-19”。

图片来自Science, 2020, doi:10.1126/science.abc0473。
论文通讯作者、麻省总医院(MGH)癌症中心癌症流行病学主任Andrew T. Chan博士说,“这款App每天都会收集社区中的个人信息,包括他们是否感觉良好,如果不舒服,他们的具体症状是什么,以及他们是否接受过COVID-19检测。”这款app旨在深入了解关于COVID-19的热点地区在哪里以及需要注意的新症状,它可能作为一种有用的规划工具,为自我隔离提供指导方针方面的信息,确定需要增加呼吸机和扩大医院容量的地区,并提供实时数据,为未来的疫情爆发做好准备。
这款称为COVID症状追踪应用程序(COVID Symptom Tracker)的app于3月24日在英国推出,3月29日在美国上市。自推出以来,已经有超过300万人使用过它。
9.Science揭示衰老新机制!免疫细胞缺陷导致我们衰老!
doi:10.1126/science.aax0860
T细胞本应保护我们免受病原体的侵害,但一项新的小鼠研究表明,它们也可能加速衰老。阻断由细胞引起的炎症或增加关键代谢分子的供应,可以减轻啮齿动物衰老相关症状的严重程度,增加了这些治疗可能对老年人有益的可能性。相关研究成果于近日发表在Science上,该研究题为"T cells with dysfunctional mitochondria induce multimorbidity and premature senescence"。
澳大利亚RMIT大学的免疫学家Kylie Quinn说,这一发现是"一个神奇的结果,它直接将新陈代谢、炎症和衰老联系起来。他们做了一项非常彻底的工作,以确保是T细胞导致老鼠迅速衰老。"
随着年龄的增长,我们的T细胞会让我们失望,成为更弱的病原体斗士。这种下降有助于解释为什么老年人更容易受到感染,而对疫苗的反应较差。随着年龄的增长,T细胞会出现衰退,原因之一是细胞内作为动力装置的线粒体开始失灵。
10.Science:意外!运动竟然可以通过细胞因子促进耐力!
doi:10.1126/science.aat3987; doi:10.1126/science.abb4116
白细胞介素-13 (IL-13)是一种由T细胞、固有淋巴细胞(ILC2s)和粒细胞分泌的细胞因子。它在过敏和抗寄生虫防御中起着重要的中介作用,具有多种作用。5月1日,来自哈佛大学陈曾熙公共卫生学院、德克萨斯大学麦戈文医学院等单位的Knudsen等人在Science上发文报道了IL-13在运动和代谢中的独特作用。该研究表明接受耐力训练的小鼠血液中IL-13含量增加,这与ILC2在肌肉中的扩张有关。相比之下,当小鼠缺乏IL-13时,运动无法导致肌肉脂肪酸利用和线粒体生物生成的增加。肌肉IL-13受体下游信号通路的激活是这一作用的关键。肌内注射腺病毒IL-13可再现运动诱导的代谢重编程过程。这一信号通路可能是为了对抗寄生虫感染的代谢压力而进化的。
实际上早在20世纪60年代初,人们就已经发现不稳定的血液和淋巴因子可以调节运动对新陈代谢的影响。最近的研究进一步支持这样一种观点,即宿主免疫细胞与其宿主组织之间的交流对于调节代谢阈值从而维持组织功能非常重要。Knudsen等人发现耐力运动增加了小鼠和人类血液中白细胞介素-13 (IL-13)的循环水平。耐力运动还导致2型固有淋巴细胞(ILC2s)的扩增,ILC2s是小鼠肌肉中产生IL -13的主要细胞类型之一。这暗示了IL-13在运动引起的适应性反应控制中的作用。研究人员使用了几种分子和生物能量分析,并生成了三个遗传模型,以确定IL-13信号在骨骼肌肉对耐力运动训练的代谢重编程中的作用。
与野生型对照动物相比,IL-13缺陷小鼠在跑步机上的跑步能力下降。研究人员对对照组和IL-13缺陷小鼠的骨骼肌进行了RNA测序,以检测IL-13在运动生理学中的作用。结果表明IL-13对静止肌肉代谢基因表达无明显影响。然而,耐力训练增加了对照组动物肌肉中线粒体和脂肪酸氧化基因的网络信号,而缺乏IL- 13的小鼠则丢失了这些基因。IL-13缺乏的肌肉在一次运动后表现出脂肪酸利用缺陷,在耐力训练后未能增加线粒体的生物发生过程。此外,对照组动物的耐力训练导致肌肉氧化纤维数量的增加和线粒体呼吸、耐力和葡萄糖耐量的改善。所有这些运动训练的代谢益处都需要完整的IL-13信号。
Knudsen等人发现,IL-13通过其受体IL-13Rα1直接作用于骨骼肌,导致Stat3的激活。在单次训练和耐力训练后,肌肉中Stat3磷酸化水平升高,而IL-13缺陷小鼠体内的这种效应消失了。研究人员发现在C2C12肌小管中,IL-13处理增加了依赖于IL-13Ra1和Stat3的线粒体呼吸。IL-13-Stat3轴控制代谢程序通过协调与两个核受体和转录调控线粒体调节因子ERRα和ERRγ引起运动训练的改变和调控。在骨骼肌中特别缺乏IL-13Ra1或Stat3的小鼠,其肌肉脂肪酸氧化能力和耐力下降。相比之下,骨骼肌中IL-13水平的升高则以Stat3依赖的方式再现了耐力运动诱导的代谢重编程,从而改善了全身葡萄糖稳态和跑步能力。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


