Cell:详解对SARS-CoV-2感染的不平衡宿主反应导致新冠肺炎产生机制
来源:本站原创 2020-04-26 13:09
2020年4月26日讯/生物谷BIOON/---冠状病毒是一组多样化的单链正义RNA病毒,其脊椎动物宿主范围广泛。四种常见的冠状病毒属(α、β、γ和δ)在脊椎动物中流通,可引起人类的轻度上呼吸道疾病和动物的胃肠炎。然而,在过去20年中,人畜共患病事件中出现了3种高致病性的人类β冠状病毒。2002-2003年,严重急性呼吸综合征(SARS)冠状病毒(SARS-
2020年4月26日讯/生物谷BIOON/---冠状病毒是一组多样化的单链正义RNA病毒,其脊椎动物宿主范围广泛。四种常见的冠状病毒属(α、β、γ和δ)在脊椎动物中流通,可引起人类的轻度上呼吸道疾病和动物的胃肠炎。然而,在过去20年中,人畜共患病事件中出现了3种高致病性的人类β冠状病毒。2002-2003年,严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)在全球范围内感染了大约8000人,病死率大约为10%,其次是中东呼吸道综合征(MERS)冠状病毒(MERS-CoV),自2012年以来,该病毒感染了大约2500人,病死率大约为36%。目前,全球正在发生新型冠状病毒SARS-CoV-2大流行,该病毒导致2019年冠状病毒病(COVID-19,也称为新冠肺炎),全球病死率有待确定。SARS-COV-2感染的特点是,大多数病例的症状包括发热、咳嗽和全身不适。更严重的COVID-19病例表现为急性呼吸窘迫综合征和急性肺部损伤以及因肺泡腔损伤引起的炎症和肺炎,进而导致发病和死亡。
宿主对病毒感染的生理反应通常是在病毒复制后的细胞水平上启动的。在病毒进入后,受感染细胞通过使用多种模式识别受体(PRR)中的任何一种来检测病毒复制的存在。这些受体通过与不同病原体之间共享的独特结构进行物理接触,成为识别细胞内外各种微生物的哨兵。
就病毒感染而言,细胞对病毒复制的检测主要是由细胞内感知在病毒复制过程中经常形成的异常RNA结构的PRR家族介导的。与病毒特异性RNA结构的接触最终导致这些受体的低聚化和下游转录因子的激活,最显著的是干扰素调节因子(IRF)和核因子κB(NFκB)。IRF和NFκB的转录激活会导致两种通用的抗病毒程序的启动。第一种涉及细胞抗病毒防御的参与,这种细胞抗病毒防御由I型和III型干扰素(IFN-I和IFN-III)的转录诱导以及随后的干扰素刺激基因(ISG)的上调介导。这种抗病毒反应的第二种涉及白细胞特定亚群的招募和协调,这主要通过趋化因子分泌来精心安排。
这种广泛的抗病毒反应给病毒带来了选择性压力,并导致了无数病毒对抗措施的演变。因此,宿主对病毒的反应一般不统一,而且感染会造成不同程度的发病率和死亡率。目前的COVID-19大流行代表着一种急性的、快速发展的全球健康危机。
为了更好地了解COVID-19的分子基础,在一项新的研究中,来自美国西奈山伊坎医学院等多家研究机构的研究人员试图在多种模型系统(包括体外组织培养、原代细胞体外感染和来自患上COVID-19的人类和动物的体内样本)中表征对感染作出的转录反应。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Imbalanced host response to SARS-CoV-2 drives development of COVID-19”。
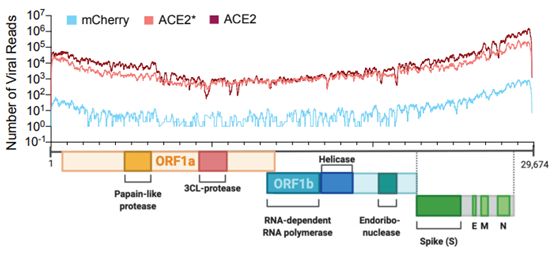
两种呼吸道病毒SARS-CoV和甲型流感病毒(IAV)均编码多种不同的拮抗剂来应对IFN-I/-III反应。对于与SARS-CoV-2密切相关的SARS-CoV,对IFN的拮抗作用被归因于ORF3B、ORF6和核衣壳蛋白(N)等基因编码产物。SARS-CoV还编码nsp1,这是一种核酸酶,参与切割宿主mRNA以防止核糖体装载并导致宿主细胞关闭。与SARS-CoV相似,IAV也编码IFN-I/I/III拮抗剂:非结构蛋白1(NS1),它通过结合和掩蔽感染过程中产生的异常RNA来阻断模式识别受体(PRR)的初始检测。
在这项新的研究中,这些研究人员在细胞系、原代细胞培养物、雪貂和COVID-19患者中重点研究了宿主对SARS-CoV-2和其他人类呼吸道病毒的反应。他们比较了宿主对SARS-CoV-2和其他呼吸道病毒感染的转录反应,以确定可能构成COVID-19生物学基础的转录特征。总的来说,他们的数据表明,与其他高致病性冠状病毒以及IAV、人副流感病毒3型(HPIV3)和呼吸道合胞病毒(RSV)等常见的呼吸道病毒相比,宿主对SARS-CoV-2感染的整体转录印迹是不同的,是异常的。
尽管存在病毒复制,但宿主对SARS-CoV-2的反应未能启动强劲的IFN-I/-III反应,同时诱导招募效应细胞所需的高水平趋化因子。鉴于免疫反应的减弱使得病毒复制得以持续,这些发现可能解释了为什么严重的COVID-19病例更经常在有合并症的个体中观察到。此外,值得注意的是,尽管对SARS-CoV-2的IFN-I/-III反应减少,但是他们观察到一致性的趋化因子特征。
这一观察的一个例外是A549-ACE2细胞和CALU-3细胞对高感染复数(multiplicity of infection, MOI)感染的反应:病毒复制在这些细胞中是强劲的,并且可以观察到IFN-I和IFN-III特征。
在这两个例子中,细胞被感染的速率理论上是每个细胞传递两个功能性病毒颗粒,除此之外,病毒库中存在的任何缺陷的干扰性病毒颗粒在病毒空斑测定方法中并不考虑在内。在这些条件下,病原体相关模式分子(PAMP)的阈值可以在病毒通过产生病毒拮抗剂来逃避检测的能力之前实现。或者,在单个细胞中加入多个基因组可能会破坏病毒成分的化学计量,这反过来就可能产生通常不会形成的PAMP。这些想法得到以下事实的支持:在对A549-ACE2细胞的低MOI感染中,高水平的病毒复制在没有IFN-I/-III诱导的情况下也可实现。综合起来,这些数据将表明,在低MOI感染下,病毒不能强劲地诱导IFN-I/-III系统,但在高MOI感染下,这一点是可以实现的。 这些动态也可能在感染过程中促进COVID-19产生。
在他们每个系统中的一个可以反复观察到的发现是细胞因子的强劲生产及其随后的转录反应。根据他们的纵向体内数据,这种反应最早在感染后3天开始,并持续到病毒清除之后。最近一项分析重症COVID-19病例与轻度COVID-19病例的研究显示,重症病例的肺部中外周源性巨噬细胞占主导地位。与此相一致,他们发现在他们所有的系统中都发生单核细胞相关趋化因子(比如CCL2和CCL8)的显著诱导。
此外,他们的数据表明,正如CXCL2和CXCL8诱导所显示的那样,中性粒细胞也可能有助于导致在COVID-19患者中观察到的这种疾病。这与显示COVID-19患者中循环中性粒细胞水平升高的数据一致,这可能具有预后价值,可用于识别有发展为严重疾病风险的个体。另外值得注意的是,在对SARS-CoV-2的反应中,两种独特升高的细胞因子是IL-6和IL1RA,这表明COVID-19和细胞因子释放综合征(CRS)之间可能存在平行关系,其中CRS是CAR-T细胞治疗后常见的一种并发症。如果情况属实,那么托珠单抗(tocilizumab)和阿那白滞素(anakinra)等药物可能会被证明对治疗COVID-19有利。未来的研究将需要正式解决这个问题。
与SARS-CoV-2一样,有人提出SARS-CoV的临床表现源于患者的免疫反应失调和IFN-I的延迟表达。基于动物模型,人们发现SARS-CoV可诱导强健的细胞因子反应,该反应通常表现为IFN-I的延迟表达,最终导致炎症性单核细胞-巨噬细胞群体的不适当招募。这一动态似乎与他们在SARS-CoV-2中观察到的情况一致,即较低水平的IFN-I和III可能是在感染后产生的。考虑到在体内观察到的适度的病毒复制水平,对低IFN表达的一个解释可能是,一小部分细胞对SARS-CoV-2的拮抗机制具有耐受性(与被感染的CALU-3细胞中的相类似),从而产生充足的IFN-I和/或IFN-III来引导免疫细胞激活和诱导干扰素刺激基因(ISG)表达。
SARS-CoV-2与这项新研究中使用的其他病毒的不同之处在于,它倾向于选择性地诱导老年人群的发病率和死亡率。这种发病率的生理学基础被认为是Ⅱ型肺细胞的选择性死亡,从而导致空气交换功能丧失和肺部液体渗漏。虽然对SARS-CoV-2感染作出的不适当的炎症反应是否是导致老年人群中异常高致死率的原因还有待确定,但是这确实解释了为什么在免疫系统健康、免疫力强的年轻人中,这种病毒感染通常是无症状的。考虑到这项新研究的发现,很容易推测老龄化人群中已经受限的免疫反应阻碍了在感染早期阶段对这种病毒传播的成功抑制,从而进一步加剧了这个年龄组的发病率和死亡率。
综上所述,这些数据表明,对SARS-CoV-2的反应在控制病毒复制和激活适应性免疫反应方面是不平衡的。鉴于这种动态,对COVID-19的治疗与IFN反应关系不大,而更多地与控制炎症有关。鉴于这些数据表明,在COVID-19患者中,许多趋化因子和白细胞介素都会升高,因此,未来的研究工作应该集中在美国食品药品管理局(FDA)批准的可以快速部署并具有免疫调节作用的药物上。(生物谷 Bioon.com)
参考资料:
Daniel Blanco-Melo et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell, 2020, doi:10.1016/j.cell.2020.04.026.
宿主对病毒感染的生理反应通常是在病毒复制后的细胞水平上启动的。在病毒进入后,受感染细胞通过使用多种模式识别受体(PRR)中的任何一种来检测病毒复制的存在。这些受体通过与不同病原体之间共享的独特结构进行物理接触,成为识别细胞内外各种微生物的哨兵。
就病毒感染而言,细胞对病毒复制的检测主要是由细胞内感知在病毒复制过程中经常形成的异常RNA结构的PRR家族介导的。与病毒特异性RNA结构的接触最终导致这些受体的低聚化和下游转录因子的激活,最显著的是干扰素调节因子(IRF)和核因子κB(NFκB)。IRF和NFκB的转录激活会导致两种通用的抗病毒程序的启动。第一种涉及细胞抗病毒防御的参与,这种细胞抗病毒防御由I型和III型干扰素(IFN-I和IFN-III)的转录诱导以及随后的干扰素刺激基因(ISG)的上调介导。这种抗病毒反应的第二种涉及白细胞特定亚群的招募和协调,这主要通过趋化因子分泌来精心安排。
这种广泛的抗病毒反应给病毒带来了选择性压力,并导致了无数病毒对抗措施的演变。因此,宿主对病毒的反应一般不统一,而且感染会造成不同程度的发病率和死亡率。目前的COVID-19大流行代表着一种急性的、快速发展的全球健康危机。
为了更好地了解COVID-19的分子基础,在一项新的研究中,来自美国西奈山伊坎医学院等多家研究机构的研究人员试图在多种模型系统(包括体外组织培养、原代细胞体外感染和来自患上COVID-19的人类和动物的体内样本)中表征对感染作出的转录反应。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Imbalanced host response to SARS-CoV-2 drives development of COVID-19”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.026。
两种呼吸道病毒SARS-CoV和甲型流感病毒(IAV)均编码多种不同的拮抗剂来应对IFN-I/-III反应。对于与SARS-CoV-2密切相关的SARS-CoV,对IFN的拮抗作用被归因于ORF3B、ORF6和核衣壳蛋白(N)等基因编码产物。SARS-CoV还编码nsp1,这是一种核酸酶,参与切割宿主mRNA以防止核糖体装载并导致宿主细胞关闭。与SARS-CoV相似,IAV也编码IFN-I/I/III拮抗剂:非结构蛋白1(NS1),它通过结合和掩蔽感染过程中产生的异常RNA来阻断模式识别受体(PRR)的初始检测。
在这项新的研究中,这些研究人员在细胞系、原代细胞培养物、雪貂和COVID-19患者中重点研究了宿主对SARS-CoV-2和其他人类呼吸道病毒的反应。他们比较了宿主对SARS-CoV-2和其他呼吸道病毒感染的转录反应,以确定可能构成COVID-19生物学基础的转录特征。总的来说,他们的数据表明,与其他高致病性冠状病毒以及IAV、人副流感病毒3型(HPIV3)和呼吸道合胞病毒(RSV)等常见的呼吸道病毒相比,宿主对SARS-CoV-2感染的整体转录印迹是不同的,是异常的。
尽管存在病毒复制,但宿主对SARS-CoV-2的反应未能启动强劲的IFN-I/-III反应,同时诱导招募效应细胞所需的高水平趋化因子。鉴于免疫反应的减弱使得病毒复制得以持续,这些发现可能解释了为什么严重的COVID-19病例更经常在有合并症的个体中观察到。此外,值得注意的是,尽管对SARS-CoV-2的IFN-I/-III反应减少,但是他们观察到一致性的趋化因子特征。
这一观察的一个例外是A549-ACE2细胞和CALU-3细胞对高感染复数(multiplicity of infection, MOI)感染的反应:病毒复制在这些细胞中是强劲的,并且可以观察到IFN-I和IFN-III特征。
在这两个例子中,细胞被感染的速率理论上是每个细胞传递两个功能性病毒颗粒,除此之外,病毒库中存在的任何缺陷的干扰性病毒颗粒在病毒空斑测定方法中并不考虑在内。在这些条件下,病原体相关模式分子(PAMP)的阈值可以在病毒通过产生病毒拮抗剂来逃避检测的能力之前实现。或者,在单个细胞中加入多个基因组可能会破坏病毒成分的化学计量,这反过来就可能产生通常不会形成的PAMP。这些想法得到以下事实的支持:在对A549-ACE2细胞的低MOI感染中,高水平的病毒复制在没有IFN-I/-III诱导的情况下也可实现。综合起来,这些数据将表明,在低MOI感染下,病毒不能强劲地诱导IFN-I/-III系统,但在高MOI感染下,这一点是可以实现的。 这些动态也可能在感染过程中促进COVID-19产生。
在他们每个系统中的一个可以反复观察到的发现是细胞因子的强劲生产及其随后的转录反应。根据他们的纵向体内数据,这种反应最早在感染后3天开始,并持续到病毒清除之后。最近一项分析重症COVID-19病例与轻度COVID-19病例的研究显示,重症病例的肺部中外周源性巨噬细胞占主导地位。与此相一致,他们发现在他们所有的系统中都发生单核细胞相关趋化因子(比如CCL2和CCL8)的显著诱导。
此外,他们的数据表明,正如CXCL2和CXCL8诱导所显示的那样,中性粒细胞也可能有助于导致在COVID-19患者中观察到的这种疾病。这与显示COVID-19患者中循环中性粒细胞水平升高的数据一致,这可能具有预后价值,可用于识别有发展为严重疾病风险的个体。另外值得注意的是,在对SARS-CoV-2的反应中,两种独特升高的细胞因子是IL-6和IL1RA,这表明COVID-19和细胞因子释放综合征(CRS)之间可能存在平行关系,其中CRS是CAR-T细胞治疗后常见的一种并发症。如果情况属实,那么托珠单抗(tocilizumab)和阿那白滞素(anakinra)等药物可能会被证明对治疗COVID-19有利。未来的研究将需要正式解决这个问题。
与SARS-CoV-2一样,有人提出SARS-CoV的临床表现源于患者的免疫反应失调和IFN-I的延迟表达。基于动物模型,人们发现SARS-CoV可诱导强健的细胞因子反应,该反应通常表现为IFN-I的延迟表达,最终导致炎症性单核细胞-巨噬细胞群体的不适当招募。这一动态似乎与他们在SARS-CoV-2中观察到的情况一致,即较低水平的IFN-I和III可能是在感染后产生的。考虑到在体内观察到的适度的病毒复制水平,对低IFN表达的一个解释可能是,一小部分细胞对SARS-CoV-2的拮抗机制具有耐受性(与被感染的CALU-3细胞中的相类似),从而产生充足的IFN-I和/或IFN-III来引导免疫细胞激活和诱导干扰素刺激基因(ISG)表达。
SARS-CoV-2与这项新研究中使用的其他病毒的不同之处在于,它倾向于选择性地诱导老年人群的发病率和死亡率。这种发病率的生理学基础被认为是Ⅱ型肺细胞的选择性死亡,从而导致空气交换功能丧失和肺部液体渗漏。虽然对SARS-CoV-2感染作出的不适当的炎症反应是否是导致老年人群中异常高致死率的原因还有待确定,但是这确实解释了为什么在免疫系统健康、免疫力强的年轻人中,这种病毒感染通常是无症状的。考虑到这项新研究的发现,很容易推测老龄化人群中已经受限的免疫反应阻碍了在感染早期阶段对这种病毒传播的成功抑制,从而进一步加剧了这个年龄组的发病率和死亡率。
综上所述,这些数据表明,对SARS-CoV-2的反应在控制病毒复制和激活适应性免疫反应方面是不平衡的。鉴于这种动态,对COVID-19的治疗与IFN反应关系不大,而更多地与控制炎症有关。鉴于这些数据表明,在COVID-19患者中,许多趋化因子和白细胞介素都会升高,因此,未来的研究工作应该集中在美国食品药品管理局(FDA)批准的可以快速部署并具有免疫调节作用的药物上。(生物谷 Bioon.com)
参考资料:
Daniel Blanco-Melo et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell, 2020, doi:10.1016/j.cell.2020.04.026.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


