肠道微生物组研究进展(第7期)
来源:本站原创 2020-04-02 15:01
本期为大家带来的是肠道微生物相关领域的研究进展,希望读者朋友们能够喜欢。
2020年4月2日讯/生物谷BIOON/---本期为大家带来的是肠道微生物相关领域的研究进展,希望读者朋友们能够喜欢。
DOI: 10.1093/nutrit/nuz106

直到最近,人类微生物组仍然是诊断和治疗疾病的新策略的未充分研究的目标。可能会破坏肠道微生物组的疾病的患病率正在增加,然而目前科学界对于定义“健康肠道”微生物组的定义尚无共识。
文章作者Leigh A. Frame说:“随着我们对肠道微生物组和营养的了解越来越多,我们正在了解它们彼此之间的影响力,以及也许对公共卫生更重要的是它们在疾病预防和治疗中的作用。”
通过他们的评论,作者发现,营养与肠道微生物组之间的双向关系正在出现,这是因为有关微生物群如何利用和产生大量和微量营养素的研究越来越多。作者发现,研究主要集中在膳食纤维的益处上,膳食纤维可作为肠道菌群的燃料,并且还发现,相比之下,蛋白质可促进微生物蛋白质的代谢以及可能存在于肠道中的潜在有害副产物的积累,从而增加了患病风险。
SMHS临床研究副教授Scott Jackson表示:“这篇文章表明,我们目前使用的测量工具无法有效识别可作为健康和疾病的有力指标的微生物和分子特征。” 因此,作者建议,未来的研究必须考虑个人对饮食的反应以及肠道微生物组对饮食干预的反应,以及强调微生物组的功能(其作用),而不只是组成(存在)。
DOI: 10.1371/journal.pbio.3000617
科学家们已经意识到,细菌在肠道中变异和进化的速度比之前认为的要快得多。但是现在,来自葡萄牙Gulbenkian de Ciência研究所的研究人员发现,某些被称为突变体的细菌细胞可以以正常情况下高1000倍的突变率进行进化,从而产生前所未有的多样性爆发。

通过使用实验室老鼠并专注于一个可以克隆出所有的人类肠道细菌的细菌,研究人员发现在可以减少突变体适应性的许多突变造成的大量垃圾中,有一个宝石:一个可以增加细菌摄取肠道特殊糖类并导致观察到的细菌多样性暴增的突变。这一发现有助于解释每个人体内微生物组的独特性以及一些治疗干预后观察到的差异。
doi:10.1084/jem.20192282
DOI: 10.3389/fcimb.2019.00434
在2019年12月发表在《Frontiers in Cellular and Infection Microbiology》上的一项研究中,东京医科牙科大学(TMDU)的研究人员表明了正常饮食对于在口腔和肠道中建立和维持适当细菌的重要性。
我们的身体是人类细胞和微生物的共生单位。这种微生物菌群不仅有害,而且现在被认为是众多生理功能的重要调节剂,例如消化,情绪,睡眠和对药物的反应,以及对糖尿病,自闭症,肥胖症和癌症的易感性。

研究人员发现,由口腔摄入食物会极大地改变口腔和肠道微生物组,并使之多样化进一步提升。尽管组成差异很大,但两者均显示出食肉杆菌科和Granulicatella属的增加,这表明经口摄入的细菌可能直接调节肠道菌群,从而影响全身健康。尽管口腔微生物群改变比肠道改变更为显著,但元基因组预测显示肠道中的差异途径更加丰富,特别是与脂肪酸代谢相关的途径。
DOI:10.1126/sciadv.aax6328

DOI: 10.1016/j.cell.2020.02.016
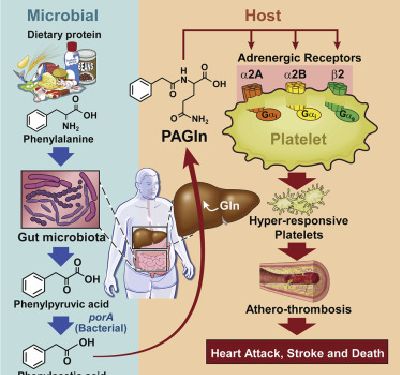
克利夫兰诊所的研究人员已经确认了一种肠道微生物的副产品--苯乙酰谷氨酰胺(PAG)--与心血管疾病的发展有关,包括心脏病、中风和死亡。这项研究近日发表在《Cell》杂志上。
"在过去的十年里,有越来越多的数据表明,肠道微生物在健康中扮演着重要的角色,尤其是在它与心脏病相关的时候," Hazen博士说,他同时也是克利夫兰诊所微生物组和人类健康中心的主任。"我们发现,血液中的PAG会以几种不同的方式增加心血管疾病的风险。"
通过对5000多名患者3年多的样本进行分析,研究人员发现,PAG水平升高可以预测哪些患者将来会经历心脏病发作和中风等不良心脏事件,还可以预测2型糖尿病患者(心血管疾病的独立危险因素)。动物模型和微生物移植研究表明,肠道微生物产生的PAG在驱动心血管疾病中发挥重要作用。
研究人员还分析了病人样本中的全血、富含血小板的血浆和分离的血小板,以了解PAG如何影响细胞过程。然后,他们分析了动脉损伤的动物模型,以了解PAG是如何引起细胞变化并最终演变成疾病的。Hazen博士和他的团队发现,PAG增强了血小板反应性和凝血潜能,从而增加了血栓形成的可能性,血栓是心脏病发作和中风等心脏不良事件的主要原因。
Hazen说:"我们对这一发现如此感兴趣的部分原因是,我们发现PAG与受体阻滞剂结合在一起,而受体阻滞剂是治疗心脏病的常用药物。"
对PAG升高的动物模型使用受体阻滞剂表明可以逆转PAG导致的心血管事件。此外,研究人员发现,使用基因编辑技术或药物来阻断PAG受体信号可以显着降低凝血活性。
Hazen说:"我们相信我们的发现表明受体阻滞剂的一些好处可能是由于阻止了与PAG相关的活动。受体阻滞剂已被广泛研究,并被开给许多心脏病患者使用,但据我们所知,这是首次提出这种机制来解释其某些益处。"
DOI: 10.1038/s41564-019-0659-3

“微生物组似乎对动物的健康有相当大的影响:它通过使用表观遗传学手段来激活肠道粘膜再生相关基因的活性,从而确保正常的肠道发育。但是,在无菌小鼠中,这种激活现象不会发生。在急性炎症过程中,肠道微生物也会引起遗传活性的改变。这再次强调了微生物在表观遗传调控中的关键作用。”
DOI: 10.1126/science.aaw8429

研究者发现,母亲机体所产生的SCFAs能通过位于脂肪细胞内的特殊SCFA蛋白受体信号,来指挥婴儿神经、胰腺和肠道细胞的分化和发育,该过程还能帮助维持后代机体中的能量平衡,如果没有该过程,后代很有可能对多种代谢性疾病会变得易感;下一步研究人员将会继续深入研究阐明是否SCFAs也能在人类机体中以相同的方式发挥作用,如果的确是这样的话,研究人员或许就能开发出特殊的补充剂来帮助孕妇有效避免或逆转这些问题。
DOI: 10.1038/s41586-020-2080-8
这项由来自荷兰,英国和美国的科学家做出的研究结果表明,大肠杆菌释放的毒素会导致肠道内膜细胞发生“独特”的DNA损伤模式。这一结果首次显示出细菌毒素与驱动癌症发展的遗传变化之间的直接联系。

Hubrecht研究所的Grand Challenge共同研究员Hans Clevers教授说:“众所周知,诸如烟草或紫外线之类的东西会引起DNA损伤的特定模式,这些DNA损伤指纹可以告诉我们很多有关过去可能导致癌症的风险的信息。”
研究人员说,进一步寻找肠道损伤细胞中与细菌杆菌素相关的DNA损伤指纹可以用来识别那些具有更高患病风险的群体。(生物谷 Bioon.com)

根据乔治华盛顿大学(GW)和美国国家标准研究院(National Institute of Standards and National Institute)的科学家最近发表的一篇文章,营养和饮食对肠道中的微生物组成具有深远影响,进而影响一系列代谢,激素和神经系统过程。相关文章发表在《Nutrition Reviews》杂志上。

直到最近,人类微生物组仍然是诊断和治疗疾病的新策略的未充分研究的目标。可能会破坏肠道微生物组的疾病的患病率正在增加,然而目前科学界对于定义“健康肠道”微生物组的定义尚无共识。
文章作者Leigh A. Frame说:“随着我们对肠道微生物组和营养的了解越来越多,我们正在了解它们彼此之间的影响力,以及也许对公共卫生更重要的是它们在疾病预防和治疗中的作用。”
通过他们的评论,作者发现,营养与肠道微生物组之间的双向关系正在出现,这是因为有关微生物群如何利用和产生大量和微量营养素的研究越来越多。作者发现,研究主要集中在膳食纤维的益处上,膳食纤维可作为肠道菌群的燃料,并且还发现,相比之下,蛋白质可促进微生物蛋白质的代谢以及可能存在于肠道中的潜在有害副产物的积累,从而增加了患病风险。
SMHS临床研究副教授Scott Jackson表示:“这篇文章表明,我们目前使用的测量工具无法有效识别可作为健康和疾病的有力指标的微生物和分子特征。” 因此,作者建议,未来的研究必须考虑个人对饮食的反应以及肠道微生物组对饮食干预的反应,以及强调微生物组的功能(其作用),而不只是组成(存在)。
人体肠道细菌的多样性是一个重要的健康生物标志物,影响着肥胖、炎症性肠病等多种疾病,影响着各种治疗方法的疗效。但如何保持它的多样性仍然是一个谜。由Isabel Gordo领导的科学家们首次实时观察到,微生物群多样性爆发由具有与癌症相似突变率的细菌细胞引起。

在未来,研究人员希望找到通过饮食干预或化合物来调节突变影响的方法。
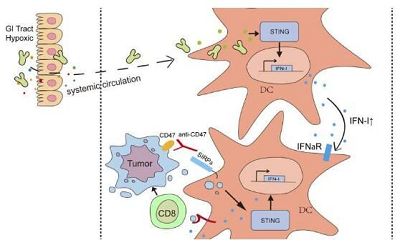
近日,一项刊登在国际杂志Journal of Experimental Medicine上的研究报告中,来自西南医学中心和芝加哥大学等机构的科学家们通过研究发现,生活在肠道中的细菌或会在肿瘤中积累并改善小鼠癌症免疫疗法的治疗效力,相关研究结果表明,利用双歧杆菌(Bifidobacteria)来治疗癌症患者或能增强其对CD47免疫疗法反应,CD47免疫疗法是一种目前在多种临床试验中进行评估的广泛使用的抗癌疗法。
CD47是许多癌细胞表面表达的蛋白质,抑制该蛋白能够促进患者机体的免疫系统攻击并破坏肿瘤,靶向作用CD47的抗体目前正在多项癌症临床试验中使用,但对实验室小鼠进行的研究往往会产生混合的结果,有些小鼠对抗CD47疗法能够产生反应,而有些则并不会产生反应。

这项研究中,研究者发现,实验室动物对疗法的反应依赖于生活在其肠道中的细菌类型;如果肠道菌群被多种抗生素混合制剂杀死的话,正常情况下对抗CD47疗法能够产生反应的肿瘤小鼠往往并不会对疗法产生反应,相比之下,当给动物补充双歧杆菌后,抗CD47疗法就会有效治疗通常并不会产生反应的小鼠;双歧杆菌是一种存在于健康小鼠和人类肠道中的细菌类型,此前有研究发现,双歧杆菌对溃疡性结肠炎患者治疗有效。
让研究人员非常不可思议的是,他们发现,双歧杆菌并不会在肠道中积累,其会迁移到肿瘤中,在肿瘤中激活名为STING通路(干扰素基因刺激通路,the stimulation of interferon genes pathway)的免疫信号通路,从而就会产生免疫信号分子并激活免疫细胞的表达,当与抗CD47疗法相结合时,这些被激活的免疫细胞就会攻击并破坏周围的肿瘤组织。
研究者Fu说道,本文研究结果表明,肠道菌群或能通过在肿瘤内部定植来增强抗CD47疗法的抗肿瘤效应,当给予特定的细菌或其工程化菌群就能作为一种有效的策略来调节多种抗肿瘤免疫疗法的功效;本文研究货位研究人员深入调查肿瘤内部细菌所产生的效应提供了一种新思路,同时也能帮助解释为何癌症患者无法对免疫疗法产生反应。
长期以来,人们已经认识到了生活方式对于调节体内的微生物的重要性,并且阐明了它们对我们全身健康的复杂协同作用。现在,日本的研究人员已经证明了正常饮食对于我们个体口腔和肠道菌群的组成和平衡的重要性。
我们的身体是人类细胞和微生物的共生单位。这种微生物菌群不仅有害,而且现在被认为是众多生理功能的重要调节剂,例如消化,情绪,睡眠和对药物的反应,以及对糖尿病,自闭症,肥胖症和癌症的易感性。
中风后恢复的患者通常会出现吞咽困难,因此需要通过导管喂食以绕过口腔。 “我们假设恢复口服食物摄入量可以改变管饲患者的口腔和肠道微生物群落的组成,”文章作者, TMDU牙科学和口腔修复副教授Haruka Tohara解释说。 “为了测试这一点,我们比较了八名中风患者在恢复口服食物摄入前后的口腔和肠道微生物组特征。”

“我们通过对采集来自患者经管饲喂和转回正常饮食后收集的唾液和粪便样本中的16s rRNA进行测序,评估了口腔和肠道微生物群的分布。
日前,一篇发表在国际杂志Science Advances上的研究报告中,来自格拉斯哥大学等机构的科学家们通过研究描述了一种新型分子,其能建立肠道微生物组和大脑之间的直接关联,该分子或能导致临床前小鼠模型机体中大脑细胞功能的抑制。
这项研究中,研究人员在小鼠的肠道和大脑中鉴别出了两种新型的细菌分子,他们利用质谱成像技术(MSI,mass spectrometry imaging)在这些分子扩散到大脑不同部位之前绘制出了其分子图谱,这些分子是由肠道微生物组的细菌所产生的。在小鼠大脑特殊区域中发现的特殊分子与肉碱(carnitine)拥有相似的结构,肉碱是用来帮助燃烧脂肪产生能量的特殊分子。

肠道微生物组的改变往往与多种神经性疾病发生直接相关,然而目前研究人员并未得到证据表明肠道微生物组的化合物与大脑之间存在直接的相互作用。研究者Donal Wall说道,肠道微生物组和大脑之间的交流沟通如今被认为在机体神经健康上扮演关键角色;文章中研究人员所使用的新技术或能帮助阐明肠道微生物组和大脑之间的分子交换,这在很多疾病中可能具有非常重要的生物学意义。
研究者表示,肠道微生物组的改变或与多种神经性疾病有关,理解其二者之间的微生物沟通机制或许对于阐明某些疾病的发病机制非常重要;这项研究中,当肠道微生物组化合物进入到小鼠大脑后其会模拟并与肉碱分子一起影响小鼠大脑的功能,这或许是该研究领域的一大发现。文章中,研究人员首次机械性地描述了微生物分子能够抑制中枢神经系统的线粒体的功能,肠道微生物组所产生的两种新型分子首先会进入小鼠模型的大脑中,并能集中起来对抗肉碱分子的功能。
最后研究者Richard Burchmore表示,基于小鼠模型大脑中这些特殊分子的功能和位置,目前我们需要深入研究来调查微生物组在神经性疾病发生状况下扮演的关键角色,尤其是描述线粒体功能异常的部位,以及肠道微生物组是如何及在哪里被干扰的;诸如质谱成像技术等先进的成像技术或能帮助科学家们深入发现样本中的一些细节性分子事件,本文研究就是一个很好的例子,质谱成像技术就能作为一种创新的技术被研究者利用,从而得到一些非常有价值的科学证据,并帮助解析此前研究者并不知晓的分子关联。

克利夫兰诊所的研究人员已经确认了一种肠道微生物的副产品--苯乙酰谷氨酰胺(PAG)--与心血管疾病的发展有关,包括心脏病、中风和死亡。这项研究近日发表在《Cell》杂志上。
苯丙氨酸是一种存在于许多食物中的氨基酸,包括以植物和动物为基础的蛋白质来源,如肉类、豆类和大豆。勒纳研究所心血管与代谢科学系主任、米勒家族心脏血管胸科研究所预防心脏病和康复科共同主任Stanley Hazen领导的研究小组发现当苯丙氨酸被肠道内的微生物分解后,它产生的副产品(代谢物)PAG最终会出现在血液中,导致心脏病。
通过对5000多名患者3年多的样本进行分析,研究人员发现,PAG水平升高可以预测哪些患者将来会经历心脏病发作和中风等不良心脏事件,还可以预测2型糖尿病患者(心血管疾病的独立危险因素)。动物模型和微生物移植研究表明,肠道微生物产生的PAG在驱动心血管疾病中发挥重要作用。
研究人员还分析了病人样本中的全血、富含血小板的血浆和分离的血小板,以了解PAG如何影响细胞过程。然后,他们分析了动脉损伤的动物模型,以了解PAG是如何引起细胞变化并最终演变成疾病的。Hazen博士和他的团队发现,PAG增强了血小板反应性和凝血潜能,从而增加了血栓形成的可能性,血栓是心脏病发作和中风等心脏不良事件的主要原因。
Hazen说:"我们对这一发现如此感兴趣的部分原因是,我们发现PAG与受体阻滞剂结合在一起,而受体阻滞剂是治疗心脏病的常用药物。"
对PAG升高的动物模型使用受体阻滞剂表明可以逆转PAG导致的心血管事件。此外,研究人员发现,使用基因编辑技术或药物来阻断PAG受体信号可以显着降低凝血活性。
Hazen说:"我们相信我们的发现表明受体阻滞剂的一些好处可能是由于阻止了与PAG相关的活动。受体阻滞剂已被广泛研究,并被开给许多心脏病患者使用,但据我们所知,这是首次提出这种机制来解释其某些益处。"
近日,来自德国癌症研究中心和耶路撒冷希伯来大学的科学家证明,肠细菌会影响肠道粘膜细胞中的DNA表达特征,从而对肠道的发育以及炎症反应产生很大的影响。

大量的研究工作表明,肠道微生物群及其组成与一系列疾病,例如从肠道炎症性疾病,代谢性疾病,癌症,自闭症和抑郁症等有关。然而,这些研究通常仅显示两者之间的相关性,并不清楚肠道微生物如何影响疾病的发生。对此,来自德国癌症研究中心(DKFZ)的Frank Lyko和来自耶路撒冷希伯来大学的Yehudit Bergman试图联手解决这个问题。
在该研究中,研究人员比较了具有正常微生物组的小鼠和在无菌条件下生长的小鼠的肠道粘膜细胞的DNA修饰情况。他们专注分析了DNA甲基化情况。研究人员注意到,在无菌和微生物定殖的动物之间,肠道上皮细胞DNA甲基化模式存在很大差异。在后者中,他们发现了一组由去甲基化激活的“前哨基因”,它们负责健康肠道中肠粘膜的正常再生。
在化合物处理诱发急性炎症的模型中,研究者们发现:具有肠道微生物定殖的小鼠出现肠道粘膜细胞DNA甲基化减少的现象,最终激活了与肠道炎症以及癌症有关的许多基因的表达。相反地,无菌小鼠肠道细胞DNA的遗传活性则没有明显的变化。 “这表明甲基化的差异是由于细菌而不是化学物质引起的,”
进一步,作者发现这种DNA甲基化作用取决于细胞脱甲基酶TET2和TET3的活性,如果关闭上述基因的活性,则在诱导炎症发生的过程中不会引起基因组甲基化的任何变化。
近日,一项刊登在国际杂志Science上的研究报告中,来自东京农工大学等机构的科学家们通过对小鼠进行研究发现,目前的肠道微生物或能塑造后代后期生活中机体的代谢状况,文章中,研究人员描述了他们对小鼠的研究结果以及该研究结果的意义。

研究者表示,目前研究人员进行了大量研究来阐明母亲机体肠道微生物组对婴儿健康的影响,但却很少有人研究母亲肠道微生物组和婴儿肠道微生物组之间的关联,基于此,研究人员就想通过研究来阐明母亲机体微生物组在后代后期生活中患代谢性疾病(与母亲孕期微生物组所发生的改变相关)上所扮演的关键角色,研究人员对生活在正常和无菌状况下的怀孕小鼠进行研究来观察其二者之间是否存在差异。
研究者发现,随着后代发育,出生自孕期生活在无菌环境下的母亲的后代或许更易于患多种疾病,包括肥胖和葡萄糖耐受等,为了阐明引发这一结果的原因,研究人员对短链脂肪酸(SCFAs,short chain fatty acids)进行了深入研究,SCFAs是肠道微生物所驱动产生的一种代谢产物,其能帮助促进细胞生长和发育;同时其还能作为机体中肠道微生物和其它器官之间彼此交流沟通的信号分子。
根据最近在《nature》杂志上发表的研究,肠道中常见的一种细菌可能导致肠癌。
研究小组认为,将来可以通过肠道内膜细胞中检测到这种特定的DNA损伤,可以使医生识别出高风险的患病群体。

每年英国大约有42,000个新的肠癌病例,它仍然是第二大最常见的致死癌症。了解可能导致肠癌的早期诱因可能有助于医生预防其发展,并在最有可能成功治疗的早期阶段对其进行检测。
荷兰Hubrecht研究所的Hans Clevers教授及其团队着重研究了一种产生大肠杆菌毒素(colibactin)的大肠杆菌菌株,与健康人群相比,肠癌患者群体的粪便样本中这种毒素更为常见。由于大肠菌素可能会对实验室中生长的细胞造成DNA损伤,因此他们认为这种毒素可能会对肠道内膜细胞产生同样的作用。
该团队使用了人类肠道类器官(organoid),即在实验室中生长的肠道的微型复制品,并将其暴露于产大肠杆菌素的大肠杆菌中。足总和分析了共培养5个月后类器官中肠道细胞的DNA序列,发现其中的DNA损伤水平相比暴露于不产生colibactin的“常规”大肠杆菌的类器官高达两倍。
研究人员还发现,colibactin引起的DNA损伤具有特殊的模式。
为了确定由细菌引起的DNA损伤是否在肠癌中起作用,研究人员随后分析了来自英国和荷兰的5500多个肿瘤样本的DNA序列。首先,他们检查了3600多种不同癌症类型的荷兰样本中的两个大肠菌素DNA损伤指纹。指纹存在于多种肿瘤中,与其他类型的癌症相比,在肠癌中存在的频率更高。
然后,研究人员改进了对肠道癌肿瘤的研究,并分析了来自英国的2000多种肠癌样本。在这些样品中,colibactin引起的独特DNA损伤出现在4-5%的患者中。然而,尚需进一步研究来阐明毒素在这些情况下可发挥多少作用,以及微生物组的其他成分是否与肠癌的早期阶段有关。
研究人员说,进一步寻找肠道损伤细胞中与细菌杆菌素相关的DNA损伤指纹可以用来识别那些具有更高患病风险的群体。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


