近期帕金森领域研究进展一览
来源:本站原创 2020-03-31 02:54
本期为大家带来的是帕金森领域的相关研究进展,希望读者朋友们能够喜欢。
2020年3月31日讯/生物谷BIOON/---本期为大家带来的是帕金森领域的相关研究进展,希望读者朋友们能够喜欢。

DOI: https://doi.org/10.1212/WNL.0000000000009214

最后研究者Roger Barker表示,能够可靠地预测新诊断帕金森疾病患者所要遵循的临床路径或许有助于帮助规划其治疗,后期研究人员还应该进行多种疾病修饰性的干预试验,而本文研究就是以利用血液样本为例来帮助预测帕金森疾病患者的疾病进展状况。
doi.org/10.1038/s41598-020-60273-2
在该研究中,研究人员使用基因编辑技术CRISPR来改变细胞遗传密码中的单个核苷酸,并将其命名为G2019S。
施密特说:“我们可以使用某些相同的遗传技术,并将其应用于人类疾病的其他灵长类动物模型。”研究人员还使用猴干细胞来测试帕金森氏症的基因治疗。通过阻止LRRK2的表达,从而使细胞代谢发生了积极的转变。
DOI: 10.1038/s41593-020-0589-7
为了测试这一点,加州理工学院的研究小组向小鼠的胃肠道注射了αSyn聚集体,然后监测了这些聚集体的迁移情况。
为了研究GCase对PD相关症状的影响,研究小组使用了经过基因工程改造以过表达αSyn的小鼠,并向这些动物注射了编码GCase的基因。这些基因被包装在腺相关病毒(AAV)的载体中。研究小组发现,GCase能部分恢复这些小鼠的正常肠道功能,并减少肠道神经元的聚集。
英国帕金森大学研究副主任戴维·德克斯特教授说:“帕金森氏症患者迫切需要一种新的治疗方法,以阻止病情发展,而不仅仅是掩盖症状。帕金森氏症研究的最大挑战之一是如何使药物超越血脑屏障,因此, BT13发现为研究探索开辟了新途径,该分子具有极大的前景,有望成为减缓或加速血栓形成的方法,从而有效治疗帕金森氏症。
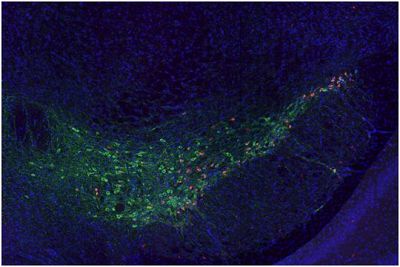
在一项新的研究中,来自美国华盛顿大学的研究人员发现了帕金森病、APOE和痴呆之间存在关联性的线索。他们发现有害的帕金森病蛋白在具有APOE高风险变体的小鼠的大脑中扩散得更快,而携带这种变体的帕金森病患者的记忆力和思维能力下降得更快。这些发现可能导致靶向APOE的疗法来减缓或预防帕金森病患者的认知能力下降。相关研究结果发表在2020年2月5日的Science Translational Medicine期刊上,论文标题为“APOE genotype regulates pathology and disease progression in synucleinopathy”。
在美国,估计有93万人患有帕金森病。人们认为这种疾病是由一种称为α-突触核蛋白(alpha-synuclein)的蛋白的有毒团块引起的。这种蛋白堆积在大脑中负责运动的一部分中。这会导致脑细胞损伤并杀死它们。
在运动症状出现很多年后,认知问题就会出现。这些与运动问题有关的蛋白聚集物也与痴呆有关,但是这种情况如何发生尚不清楚。Davis和他的同事们(包括论文通讯作者David Holtzman博士)观察到了APOE危险性的线索。
Davis说,“一旦帕金森病患者出现痴呆症状,他们及其家人在经济和情感上的代价将是巨大的。如果我们能降低他们的痴呆风险,那么我们就能显著提高他们的生活质量。”
DOI: 10.1038/s41586-020-1984-7
区分这两种疾病具有一定困难,因为两者早期症状相似:运动障碍,震颤,睡眠状态下无法控制的运动,语言障碍等。然而,两种疾病的进展不同,因此可能需要不同的治疗方案。

两种疾病的特征都是在神经系统中沉积一种称为α-突触核蛋白(aSyn)的蛋白质。这种蛋白质会经历错误折叠的过程而发生变形。这些错误折叠的蛋白质聚集在一起,并毒害负责大脑功能(尤其是运动技能)的周围健康神经细胞。“这些错叠的团块的形成将持续数年甚至数十年,直到造成足够的损害以使人开始出现运动障碍的迹象。”
DOI:10.3389/fncel.2019.00540
doi:10.1038/s41467-020-14321-0
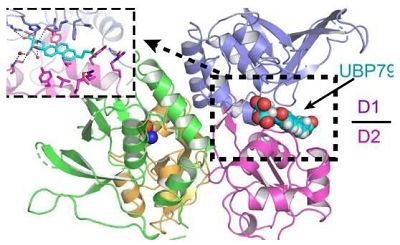
文章中,研究人员详细描述了这种新型化合物如何抑制或阻断特定NMDARs的活性,通过抑制某些NMDARs并让其它正常发挥功能,研究人员鉴别出了不同类型的NMDA受体在健康和疾病大脑中所扮演的关键角色。研究者Jue Xiang Wang解释道,这项研究中,我们揭示了名为UBP791的新型化合物靶向作用NMDAR亚单位GluN2C和GluN2D的机制。
研究者Wang说道,UBP1700要比之前的化合物版本更加精确,而且更具潜力,这一点非常重要,因为目前研究人员仅需要少量的化合物就能够关闭靶向性受体的功能,这就限制了化合物所产生的副作用的潜力;后期研究人员还会继续通力合作来优化这种新型化合物使其能够更加广泛地被应用。
doi:10.1038/s41586-020-1968-7.
在一项新的研究中,来自比利时天主教鲁汶大学的研究人员发现ATP13A2基因缺陷通过破坏多胺的细胞运输导致细胞死亡。当这种情形发生在控制身体运动的大脑部分中时,这会导致帕金森病。相关研究结果于2020年1月29日在线发表在Nature期刊上,论文标题为“ATP13A2 deficiency disrupts lysosomal polyamine export”。
鉴于这项研究揭示了ATP13A2的作用,这些研究人员可以开始寻找影响它的功能的分子。(生物谷Bioon.com)

根据最近发表的一项研究,患有帕金森氏病的人比健康人群更容易出现视力问题,例如视力模糊,眼部干涩,深度感知以及适应光线快速变化的问题。研究还发现,此类问题会影响一个人的日常活动。相关结果发表在《neurology》杂志上。

研究作者,荷兰奈梅亨的拉德布德大学医学中心医学博士Carlijn D.J.M.说:“对帕金森氏症患者而言,拥有健康的视力尤其重要,因为它可以帮助补偿由疾病引起的运动问题,并有助于降低跌倒的风险。我们的研究不仅发现患有帕金森氏病的人存在眼睛问题,而且还发现这些问题可能会影响他们的日常生活。然而,大多数眼疾是可以治愈的,因此,重要的是,帕金森氏症患者必须进行筛查和处理。”
这项研究涉及了848名帕金森氏症患者,他们的平均患病时间为7年。作者将他们与没有患病的250人进行了比较。两组参与者的平均年龄均为70岁。
研究人员发现,帕金森氏症患者中有82%的人存在一种或多种眼部疾病,而没有这种疾病的人中有48%的人存在这种疾病。研究人员还发现,与帕金森氏症患者相比,眼疾困扰了68%的人的日常生活,而健康人群这一数值为35%。
“眼疾使帕金森氏症患者的日常生活更加困难,例如,我们发现一半的研究参与者在阅读方面遇到问题,而33%的眼疾会导致无法正常驾驶。患有帕金森氏症的人如果表示自己有眼部疾病,应转介给专家进行进一步评估,及时治疗和改善生活质量。”
doi:10.3233/JPD-191724
为了能为新诊断的帕金森疾病患者提供最好的医疗护理,一种能预测其认知和运动进展的方法或许能超越单纯的临床参数,对其疾病管理或许会产生重大的影响;近日,一项刊登在国际杂志Journal of Parkinson's Disease上的研究报告中,来自纽卡斯尔大学等机构的科学家们通过研究表示,一种检测炎性和细胞衰老生物标志物的血液检测手段或许能够可靠地预测个体的认知下降,包括识别出帕金森疾病患者将要出现的早期痴呆和运动障碍等。

研究者Gabriele Saretzki博士说道,与帕金森疾病相关的痴呆症累积发生率大约为80%,相比同龄对照人群而言,帕金森疾病个体出现认知损伤的可能性是前者的5-6倍,帕金森疾病是一种与炎症相关的疾病,此前研究者发现,血液中一种促炎性的特性或能预示患者更快的临床进展,这项研究中,研究人员想要重复这一研究结果,并研究细胞老化的特殊标志物,细胞衰老过程往往与机体炎症和神经变性发生直接相关。
研究者随着时间分析了血源性运动标志物和认知功能之间的观点来阐明,是否这能够帮助预测新诊断的帕金森疾病患者的疾病进展状况,这项研究中,有超过150名新诊断的帕金森疾病患者都参与到了ICICLE-PD(认知损伤的纵向评估及帕金森疾病研究项目,Cognitive Impairments in Cohorts with Longitudinal Evaluation-Parkinson's Disease)计划中,其中有99名对照在36个多月的随访中接受了机体和认知的评估。
研究者分析了是否细胞衰老的标志物(比如端粒长度、p16和p21的表达)及血液中的炎性标志物能在接下来的36个月里帮助预测患者的认知及运动进展状况,研究者在基线时间和18个月时分别测定了患者机体的平均白细胞端粒长度、衰老标志物p21和p16的表达,同时他们还从当前的基线数据中选择了五种炎性标志物。
研究结果表明,相比年龄匹配的健康对照个体而言,帕金森疾病患者在基线和18个月时往往端粒较短,而在3年后患上痴呆症的帕金森患者相比未患痴呆症的个体而言端粒长度发生了明显缩短,基线时p16的水平也与36个多月机体运动和认知能力下降有关,而在基线时简单的炎症总结评分能够更好地帮助预测帕金森疾病患者36个月后的认知能力状况。
研究者Saretzki说道,开发合适的基于血液的生物标志物来预测患者的预后对于理解诸如帕金森疾病等多种神经变性疾病的发生至关重要;研究者后期还需要进行深入的研究来证实他们所鉴别的标志物,但这最终或能帮助开发出更具靶向性的疗法,此外,理解预测疾病过程的生物学改变或许对于未来开发多种疾病疗法也至关重要。
在最近一项研究中,科学家们使用基因编辑工具,将疾病相关基因突变引入猴源干细胞中,并成功地抑制了帕金森氏症患者经常会出现细胞生化异常反应。
文章作者,威斯康星大学麦迪逊分校Marina Emborg教授说:“我们现在知道如何将一个单一的突变(点突变)插入到猴源干细胞中。”相关结果发表在最近的《Scientific Reports》杂志上。

在人类帕金森氏症患者中,这种突变导致参与细胞代谢的酶LRRK2过度活跃。这项新研究首次产生了仅产生具有G2019S突变的细胞,这使得研究该突变在疾病中的作用变得更加容易。
Emborg教授说:“具有这种突变的干细胞的代谢效率不如正常细胞,就像我们在帕金森氏症中所见那样。突变细胞在体外培养中的寿命较短。当它们暴露于氧化应激时,它们的抵抗力就会减弱。”
突变的细胞还具有帕金森氏症的另一个缺点:与其它细胞的连接缺乏光泽。当研究人员刺激突变的干细胞分化为神经元时,他们形成的分支也明显较少。
\帕金森氏病(PD)是一种使人衰弱的神经退行性疾病,损害了全球数百万老年人的运动功能。通常情况下,PD患者会在运动症状发作前数年出现胃肠功能紊乱的症状,例如便秘等。
对帕金森氏病患者的大脑进行检查后的结果显示,控制运动的大脑细胞中存在着α-突触核蛋白(α-Syn)团块。在最近的一项研究中,加州理工学院的研究人员在小鼠肠道神经元中植入了α-Syn聚集体,发现这些团块可以向上传播,从而影响大脑中的神经元,而且这个过程与年龄有关。

正常情况下,小鼠产生的酶能够分解这些团块,但是随着年龄的增长,它们可能会失去这种能力,这可以解释为什么帕金森症高发于老年人群体。研究人员表明,给小鼠注射带有编码该酶的基因的载体药物有助于减轻团块的聚集,并一定程度上恢复肠道的正常功能。
相关结果发表在最近的《Nature Neuroscience》杂志上。
由于在PD患者的肠道神经元中也发现了α-Syn聚集体,因此一些研究人员推测α-Syn聚集体首先在肠道神经系统中开始,然后从肠道神经元转移到大脑神经元,并在此过程中形成其它聚集体。
在成年小鼠中,研究小组确实发现了αSyn簇的形成,但他们没有发现运动障碍相关症状。在老年小鼠(约16个月大)中,作者发现小鼠既表现出胃肠功能紊乱,又表现出运动症状。
已知葡糖脑苷脂酶(GCase)具有分解αSyn簇的能力。如果小鼠丧失了制造这种酶的能力,αSyn蛋白就会开始聚集
DOI: 10.1002/mds.27943
根据最近一项研究,一个有前途的分子为能够阻止或延缓帕金森氏症的新疗法提供了希望。赫尔辛基大学的研究人员发现,分子BT13既有可能提高多巴胺的水平,又可以保护产生多巴胺的脑细胞免于死亡。
这项研究的结果由帕金森大学英国共同资助,并于今天在线发表在《Movement Disorders》杂志上。该研究结果表明,注射该分子后,小鼠大脑中的多巴胺水平增加。 此外,BT13还激活了小鼠大脑中的特定受体以保护细胞。

通常,到人们被诊断出患有帕金森氏症时,他们已经失去了70-80%的多巴胺分泌细胞。尽管目前的治疗方法可以缓解症状,但没有什么可以减缓其进程或阻止更多脑细胞的流失,而且随着多巴胺水平的持续下降,症状会加重,并且可能会出现新的症状。
现在,研究人员正在努力改善BT13的性能,使其更有效地作为一种潜在的治疗方法,如果成功的话,可以使英国帕金森氏症的145,000人受益。
该研究基于先前针对另一种靶向大脑中相同受体的分子神经胶质细胞系神经营养因子(GDNF)的研究,这是一种针对帕金森氏症的实验性疗法。
但是,GDNF蛋白需要复杂的手术才能将药物递送到大脑,因为它是一个大分子,无法穿越血脑屏障。相比之下,较小的分子BT13能够穿过血脑屏障,因此,如果在进一步的临床试验中证明是有益的,则可以更容易地作为治疗药物使用。
doi:10.1126/scitranslmed.aay3069.
帕金森病是一种进行性神经系统疾病,它的特征是震颤、僵硬、动作缓慢和平衡受损。痴呆是帕金森病最严重的后果之一。80%的帕金森病患者在诊断后的20年内出现痴呆的症状,并且携带APOE基因特定变体的患者处于特别高的风险中。

论文第一作者、华盛顿大学神经学助理教授Albert Davis博士说,“痴呆给帕金森病患者和他们的看护者造成了巨大损失。痴呆产生通常决定着帕金森病患者是否能够留在家里还是必须进入疗养院。”
在运动症状出现很多年后,认知问题就会出现。这些与运动问题有关的蛋白聚集物也与痴呆有关,但是这种情况如何发生尚不清楚。Davis和他的同事们(包括论文通讯作者David Holtzman博士)观察到了APOE危险性的线索。
一种称为APOE4的APOE变体将患阿尔茨海默病的风险提高了三至五倍。与帕金森病一样,阿尔茨海默病是一种由有毒的蛋白聚集物在整个大脑中扩散引起的神经退行性疾病,不过这种疾病涉及的某些蛋白有所不同。APOE4增加了阿尔茨海默病痴呆的几率,这部分上是因为它刺激阿尔茨海默病蛋白聚集成团块,从而导致大脑损伤。这些研究人员猜测APOE4同样会触发帕金森病蛋白的毒性聚集物生长。
通过研究具有容易形成蛋白团块的α-突触核蛋白形式的小鼠后,Davis、Holtzman及其同事们对这些小鼠进行基因改造,使得它们携带人类APOE变体--- APOE2、APOE3或APOE4---之一,或者根本就没有APOE。
这些研究人员发现,APOE4小鼠(即携带APOE4的小鼠)比APOE3小鼠或APOE2小鼠具有更多的α-突触核蛋白聚集物。进一步的实验表明这些蛋白团块也在APOE4小鼠中更广泛扩散。总之,这些发现表明APOE4直接参与了这些小鼠的大脑疾病症状的恶化。
Davis说,“真正突出的是APOE2小鼠受到的影响比其他小鼠要少。它实际上可能具有保护作用,我们正在对这一点进行研究。如果我们确实发现APOE2具有保护作用,我们也许能够利用这种信息设计疗法以降低痴呆风险。”
为了研究APOE变体对帕金森病患者出现痴呆的影响,这些研究人员分析了来自三组帕金森病患者的公开数据。他们对两个患者队列---一个队列来自帕金森病进展标志物计划(Parkinson's Progression Markers Initiative),有251名患者;另一个队列来自华盛顿大学运动障碍中心(Washington University Movement Disorders Center),有170名患者---进行了多年追踪。在这两个队列中,APOE4患者(携带APOE4的患者)的认知能力下降快于APOE3患者。具有两个APOE2拷贝的人非常罕见,但是在研究期间,具有两个APOE2拷贝的三名患者中没有一个显示出任何认知下降。
第三个队列来自神经遗传学研究联盟(NeuroGenetics Research Consortium),由1030名帕金森病患者组成,仅对这些患者的认知能力进行了一次评估。这些研究人员发现,与APOE3患者或APOE2患者相比,这个队列中的APOE4患者在更年轻时就出现了认知问题,并且在他们进行评估时就出现了更严重的认知缺陷。
Davis说,“帕金森病较为常见,但是还有其他一些罕见的疾病,它们也是由α-突触核蛋白聚集引起的,而且也具有非常有限的治疗选择。利用药物靶向APOE可能是改变这类疾病进程的一种方式。”
APOE不会影响患上帕金森病的总体风险或运动症状恶化的速度,因此,APOE靶向疗法可能避免痴呆,而未对其他症状有影响。Davis说,即便如此,这可能还是有益的。
近日,德克萨斯州休斯敦大学健康科学中心研究人员开发了一种用于区分两类神经退行性疾病——帕金森氏病(PD)和多系统萎缩(MSA)的方法。相关结果近日发表在《Nature》杂志上。

“对医生而言,重要的是要有一种客观的方法来区分PD和MSA,以便为患者提供最佳的护理。目前,区分他们的唯一方法是等待并观察疾病的进展,而MSA的恶化速度更快一些。”文章资深作者,UTHealth麦戈文医学院的神经学系教授Claudio Soto博士说 “由于两种疾病的误诊率很高,因此我们需要找到一种在早期症状发作时就将两者区别开的方法。”
研究人员利用Soto开发的蛋白质错误折叠循环扩增(PMCA)技术检测先前与Creutzfeldt-Jakob和Alzheimer病等疾病相关的错误折叠的蛋白质,并且围绕错误折叠的aSyn聚集体作为开发PD生物化学诊断的方法。
最新研究表明,aSyn-PMCA能够以99.5%的总灵敏度区分PD和MSA,这可以帮助医生更早地了解他们需要解决的疾病。该研究还有助于从分子角度了解这些疾病的发生基础。
“我们的最新研究表明,PD和MSA的aSyn聚集体具有不同的特性,因此,通过放大其中的差异,我们可以高效地检测出患者患有哪种疾病,” Soto说。 “这对患者的准确诊断和临床护理以及针对这两种疾病的新的特异性治疗方法的开发都具有重大意义。”
近日,一项刊登在国际杂志Frontiers in Cellular Neuroscience上的研究报告中,来自布法罗大学的科学家们通过研究深入剖析了α-突触核蛋白,该蛋白与帕金森疾病发病直接相关;其会在患者大脑中形成异常的团块,但如今科学家们并不清楚其背后的分子机制和原因。
这项研究中,研究人员揭示了α-突触核蛋白的基本特性,并重点对该蛋白名为非淀粉质组分(NAC, non-amyloidal component)的部分进行了研究,他们对果蝇幼虫进行遗传工程化修饰使其能够产生正常和突变形式的人类α-突触核蛋白。研究者表示,NAC区域似乎能够帮助α-突触核蛋白通过一种名为轴突的通道,当NAC区域缺失时,α-突触核蛋白就不会在轴突中移动。
此外,研究者还发现,缺失NAC区域的α-突触核蛋白或许能够帮助有效抑制蛋白质不必要的聚集,对果蝇进行研究后,研究者指出,他们或许有可能抑制过量α-突触核蛋白产生时(蛋白质聚集)所出现的关键问题;当遗传工程化修饰的果蝇幼虫产生过量α-突触核蛋白和缺失NAC区域的α-突触核蛋白形式时,果蝇幼虫就能够正常爬行,蛋白质并不会聚集,而且突触也会表现正常。
研究者Gunawardena说道,在果蝇幼虫中,我们能够抑制某些模拟帕金森疾病的类似症状,比如神经元中α-突触核蛋白的积累等,相关研究结果有望帮助研究人员利用NAC区域的剔除来开发新型帕金森疾病疗法;本文研究结果之所以重要的一个原因是,其展示了在整个生物体环境中有效应对帕金森疾病出现的α-突触核蛋白聚集、突触形态缺陷和运动缺陷等病理学表现。
NMDARs(N-甲基天冬氨酸受体,N-methyl-D-aspartate receptors)能够作为神经细胞的阀门,控制大脑中电信号的流动,这一类特殊的受体被怀疑存在于多种神经系统疾病中,包括阿尔兹海默病、癫痫、中风和帕金森疾病中。近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自冷泉港实验室等机构的科学家们通过研究开发出了一种化合物,其或能帮助更加精确地调查NMDARs的活性。

目前有证据表明,GluN2C和GluN2D在相同的大脑区域中存在一定的关联性,而该大脑区域中的运动功能会受到帕金森等疾病的影响,如果没有良好的抑制剂,研究人员仅能够推测GluN2C和GluN2D受体的作用。
如今,研究人员能以较高的效率和特异性抑制GluN2C和GluN2D受体的活性,同时也能够分析其在帕金森疾病发病过程中所扮演的关键角色;他们改善了靶向作用NMDAR的化合物,并利用X射线晶体学技术再现了NMDAR的物理结构,阐明受体的结构对于科学家们至关重要,随后研究人员就能够设计出新型化合物UBP791,并对其不断改善,最终制造出最新版本名为UBP1700的化合物。
在一项新的研究中,来自比利时天主教鲁汶大学的研究人员发现ATP13A2基因缺陷通过破坏多胺的细胞运输导致细胞死亡。当这种情形发生在控制身体运动的大脑部分中时,这会导致帕金森病。相关研究结果于2020年1月29日在线发表在Nature期刊上,论文标题为“ATP13A2 deficiency disrupts lysosomal polyamine export”。
帕金森病是最常见的神经退行性疾病之一,折磨着全球600多万患者。已有大约20种遗传缺陷与这种疾病有关,但是人们并不了解其中许多基因的功能。如今,这些研究人员发现ATP13A2基因缺陷如何可以引起帕金森病。
论文通讯作者、天主教鲁汶大学细胞转运系统实验室的Peter Vangheluwe解释道,“我们发现ATP13A2能够转运多胺,并且对多胺的吸收至关重要。多胺是在应激条件下支持许多细胞功能并保护细胞的必需分子。但是多胺如何在人体细胞中吸收和运输仍然是一个谜。我们的研究表明,ATP13A2在这个过程中起着至关重要的作用。”
“我们的实验表明多胺通过溶酶体进入细胞,并且ATP13A2将多胺从溶酶体转移到细胞内部。这种转运过程对于溶酶体作为细胞的'废物处理系统'正常发挥作用至关重要,而在那里,废弃的细胞物质遭受降解并被回收。”
“然而,ATP13A2基因发生的突变破坏了这种转运过程,因此多胺在溶酶体中积累。结果,溶酶体肿胀并最终破裂,从而导致细胞死亡。当这种情形发生在控制身体运动的大脑部分时,这种过程可能引发与帕金森氏病有关的运动问题和震颤。”
揭示ATP13A2的作用是帕金森氏症研究的重要一步,并且为导致这种疾病的原因提供了新的见解,但仍有许多研究工作需要开展。Vangheluwe说,“我们如今必须研究多胺转运缺陷与帕金森病中的其他缺陷之间的联系,比如大脑中的斑块积聚和线粒体功能异常。我们需要研究这些机制之间如何相互影响。”
“动物体内多胺转运系统的发现也对帕金森病以外的疾病带来影响,这是因为多胺转运蛋白在其他与年龄有关的疾病中也起作用,包括癌症、心血管疾病和几种神经系统疾病。”
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


