全文编译!上海交通大学发表Gastroenterology论文探究冠状病毒SARS-CoV-2引起的胃肠道症状和潜在粪口传播
来源:本站原创 2020-03-24 17:23
2020年3月24日讯/生物谷BIOON/---自2019年12月初以来,最初在中国最大的城市之一湖北省武汉市爆发的新型冠状病毒(SARS-CoV-2,之前称为2019-nCoV)肺炎疫情已被世界卫生组织(WHO)宣布为第六次国际关注的突发公共卫生事件,这种肺炎随后被命名为2019年冠状病毒病(COVID-19)。截至2020年2月20日,全球5大洲的26个
2020年3月24日讯/生物谷BIOON/---自2019年12月初以来,最初在中国最大的城市之一湖北省武汉市爆发的新型冠状病毒(SARS-CoV-2,之前称为2019-nCoV)肺炎疫情已被世界卫生组织(WHO)宣布为第六次国际关注的突发公共卫生事件,这种肺炎随后被命名为2019年冠状病毒病(COVID-19)。截至2020年2月20日,全球5大洲的26个国家/地区共记录了75000多例确诊病例和2130例死亡病例。
当前的研究已表明COVID-19的呼吸道症状,比如发烧,干咳,甚至呼吸困难,是最常见的临床表现,类似于2003年的严重急性呼吸综合征(SARS)和2012年的中东呼吸综合征(MERS),这明确地表明液滴传播和接触传播的存在。然而,在不同的研究人群中,诸如腹泻、恶心、呕吐和腹部不适等较不常见的症状的发生率存在显著差异,早期轻度的症状发作常伴有典型的呼吸道症状。来自先前SARS研究的大量证据已表明SARS冠状病毒(SARS-CoV)的胃肠道(肠道)嗜性可通过在患者(甚至出院的患者)的组织活检样本和粪便中检测到这种病毒的存在来加以证实,这可能也部分解释了病毒持续脱落的人体中的胃肠道症状、潜在复发和SARS传播。
值得注意的是,在美国确诊的首例2019-nCoV感染病例报告入院时有2天的恶心和呕吐史,然后在医院第2天出现排便不畅。便溏和两个呼吸道样本的病毒核酸测试随后均呈阳性。此外,2019-nCoV序列也可在大多数感染患者的自收集唾液中检测到,即便在鼻咽吸出物中未检测到,也是如此,而唾液样本系列监测显示住院后唾液病毒载量下降。考虑到肺外检测到病毒RNA并不意味着存在传染性病毒,进一步的阳性病毒培养物才能表明唾液腺感染的可能性和潜在的传播。最近,来自中国的两个独立实验室宣布已从患者粪便中成功分离出活的2019-nCoV。
综上所述,越来越多的临床证据表明当人们与受感染的野生动物或患者以及无症状携带者或早期有轻度肠道症状的患者接触时,除呼吸系统之外的消化系统可能会成为另一种感染途径,而这一点在先前的研究中肯定被忽视或低估了。接下来,临床医生在及时发现有初始的胃肠道症状的患者时应当保持谨慎小心,并探讨在病毒转化发生延迟的情形下的感染持续时间。
迄今为止,借助于下一代测序技术的分子建模已揭示出2019-nCoV与SARS-CoV具有大约79%的序列一致性(sequence identity),这表明这两种B谱系β冠状病毒是高度同源的,而且之前作为SARS-CoV进入受体的血管紧张素转化酶II(ACE2)在2019-nCoV感染中也被证实起着进入受体的作用,尽管在2019-nCoV的关键受体结合结构域中发生了氨基酸突变。人们普遍认为冠状病毒在人类中的传播能力和发病机理主要取决于病毒刺突糖蛋白(下称S蛋白)的受体结合结构域、特定细胞受体(ACE2)和宿主细胞跨膜丝氨酸蛋白酶(TMPRSS)之间的相互作用,包括病毒附着、蛋白酶切割和膜融合,其中2019-nCoV与宿主细胞的结合亲和度大约为SARS-CoV与宿主细胞的73%。近期对正常人肺部和胃肠道系统的可用单细胞转录组数据进行的生物信息学分析确定了表达ACE2的细胞组成和比例,并揭示ACE2不仅在肺AT2细胞中高表达,而且也在食管上皮细胞以及来自回肠和结肠的吸收性肠上皮细胞中高表达。
在遭受病毒感染后,随着胃肠壁对外源病原体的通透性增加,被入侵的肠细胞吸收不良将导致腹泻等肠道症状出现,这在理论上表明消化系统可能易受2019-nCoV感染。另一方面,鉴于ACE2和TMPRSS(尤其是TMPRSS2)共定位在同一宿主细胞中,以及TMPRSS发挥水解作用而导致S蛋白激活和病毒进入靶细胞,因此考虑到它们在除肺AT2细胞之外的吸收性肠上皮细胞和食道上皮细胞中具有较高的共表达率,进一步的生物信息学研究为2019-nCoV的肠道感染性提供了更多证据。但是,2019-nCoV引起的胃肠道症状的确切机制在很大程度上尚不清楚。基于上述考虑,应当将基于ACE2的2019-nCoV靶向策略(如ACE2融合蛋白和TMPRSS2抑制剂)加速进入临床研究和开发用于诊断、预防或治疗的方法。
最后但并非最不重要的是,在对2019-nCoV/COVID-19的现有临床研究中已报道了轻度至中度的肝损伤,包括转氨酶升高、低蛋白血症和凝血酶原时间延长,而多达60%的SARS患者遭受肝损伤。肝组织中SARS-CoV核酸的存在证实了这种冠状病毒直接感染肝脏,针对SARS-CoV的经皮肝活检显示明显的有丝分裂和细胞凋亡,并伴有非典型特征,如嗜酸小体(acidophilic body),肝细胞膨胀和小叶活动,但未发生纤维蛋白沉积和纤维化。
人们认为SARS相关的肝毒性可能与病毒性肝炎或与因高剂量服用抗病毒药物、抗生素和类固醇引起的药物毒性有关的继发性作用以及免疫系统反应过度有关。然而,对肝脏中2019-nCoV感染的了解很少。
令人吃惊的是,最近来自两个独立队列的单细胞RNA测序数据显示胆管细胞(占总细胞的59.7%)而不是肝实质细胞(占总细胞的2.6%)中的ACE2表达显著富集,这表明2019-nCoV可能导致肝内胆管直接遭受损伤。总之,应当付出很多努力来对COVID-19患者的初步消化道症状保持警惕,以便及早发现,早期诊断,早期隔离和早期干预。(生物谷 Bioon.com)
参考资料:
1.Jinyang Gu et al. COVID-19: Gastrointestinal manifestations and potential fecal-oral transmission. Gastroenterology, 2020, doi:10.1053/j.gastro.2020.02.054.
2.GI symptoms and potential fecal transmission in coronavirus patients
https://medicalxpress.com/news/2020-03-gi-symptoms-potential-fecal-transmission.html
当前的研究已表明COVID-19的呼吸道症状,比如发烧,干咳,甚至呼吸困难,是最常见的临床表现,类似于2003年的严重急性呼吸综合征(SARS)和2012年的中东呼吸综合征(MERS),这明确地表明液滴传播和接触传播的存在。然而,在不同的研究人群中,诸如腹泻、恶心、呕吐和腹部不适等较不常见的症状的发生率存在显著差异,早期轻度的症状发作常伴有典型的呼吸道症状。来自先前SARS研究的大量证据已表明SARS冠状病毒(SARS-CoV)的胃肠道(肠道)嗜性可通过在患者(甚至出院的患者)的组织活检样本和粪便中检测到这种病毒的存在来加以证实,这可能也部分解释了病毒持续脱落的人体中的胃肠道症状、潜在复发和SARS传播。

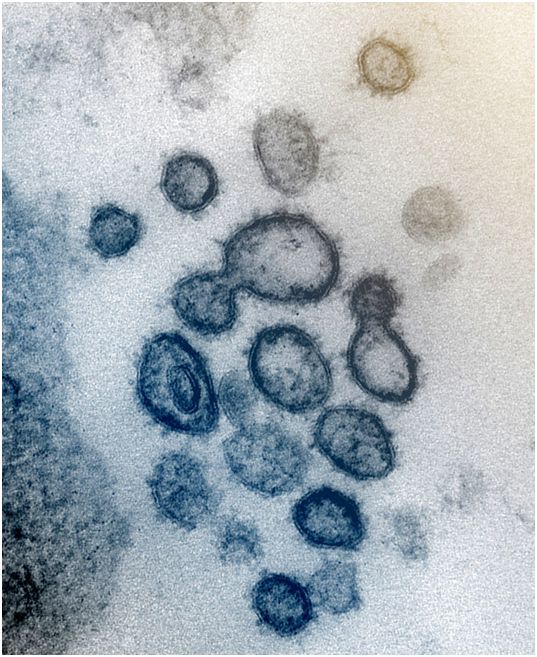
从美国一名患者中分离出的SARS-CoV-2(之前称为2019-nCoV,一种导致COVID-19的冠状病毒)的透射电子显微镜图像。SARS-CoV-2病毒颗粒出现在实验室培养的细胞表面上。图片来自NIAID-RML。
值得注意的是,在美国确诊的首例2019-nCoV感染病例报告入院时有2天的恶心和呕吐史,然后在医院第2天出现排便不畅。便溏和两个呼吸道样本的病毒核酸测试随后均呈阳性。此外,2019-nCoV序列也可在大多数感染患者的自收集唾液中检测到,即便在鼻咽吸出物中未检测到,也是如此,而唾液样本系列监测显示住院后唾液病毒载量下降。考虑到肺外检测到病毒RNA并不意味着存在传染性病毒,进一步的阳性病毒培养物才能表明唾液腺感染的可能性和潜在的传播。最近,来自中国的两个独立实验室宣布已从患者粪便中成功分离出活的2019-nCoV。
综上所述,越来越多的临床证据表明当人们与受感染的野生动物或患者以及无症状携带者或早期有轻度肠道症状的患者接触时,除呼吸系统之外的消化系统可能会成为另一种感染途径,而这一点在先前的研究中肯定被忽视或低估了。接下来,临床医生在及时发现有初始的胃肠道症状的患者时应当保持谨慎小心,并探讨在病毒转化发生延迟的情形下的感染持续时间。
迄今为止,借助于下一代测序技术的分子建模已揭示出2019-nCoV与SARS-CoV具有大约79%的序列一致性(sequence identity),这表明这两种B谱系β冠状病毒是高度同源的,而且之前作为SARS-CoV进入受体的血管紧张素转化酶II(ACE2)在2019-nCoV感染中也被证实起着进入受体的作用,尽管在2019-nCoV的关键受体结合结构域中发生了氨基酸突变。人们普遍认为冠状病毒在人类中的传播能力和发病机理主要取决于病毒刺突糖蛋白(下称S蛋白)的受体结合结构域、特定细胞受体(ACE2)和宿主细胞跨膜丝氨酸蛋白酶(TMPRSS)之间的相互作用,包括病毒附着、蛋白酶切割和膜融合,其中2019-nCoV与宿主细胞的结合亲和度大约为SARS-CoV与宿主细胞的73%。近期对正常人肺部和胃肠道系统的可用单细胞转录组数据进行的生物信息学分析确定了表达ACE2的细胞组成和比例,并揭示ACE2不仅在肺AT2细胞中高表达,而且也在食管上皮细胞以及来自回肠和结肠的吸收性肠上皮细胞中高表达。
在遭受病毒感染后,随着胃肠壁对外源病原体的通透性增加,被入侵的肠细胞吸收不良将导致腹泻等肠道症状出现,这在理论上表明消化系统可能易受2019-nCoV感染。另一方面,鉴于ACE2和TMPRSS(尤其是TMPRSS2)共定位在同一宿主细胞中,以及TMPRSS发挥水解作用而导致S蛋白激活和病毒进入靶细胞,因此考虑到它们在除肺AT2细胞之外的吸收性肠上皮细胞和食道上皮细胞中具有较高的共表达率,进一步的生物信息学研究为2019-nCoV的肠道感染性提供了更多证据。但是,2019-nCoV引起的胃肠道症状的确切机制在很大程度上尚不清楚。基于上述考虑,应当将基于ACE2的2019-nCoV靶向策略(如ACE2融合蛋白和TMPRSS2抑制剂)加速进入临床研究和开发用于诊断、预防或治疗的方法。
最后但并非最不重要的是,在对2019-nCoV/COVID-19的现有临床研究中已报道了轻度至中度的肝损伤,包括转氨酶升高、低蛋白血症和凝血酶原时间延长,而多达60%的SARS患者遭受肝损伤。肝组织中SARS-CoV核酸的存在证实了这种冠状病毒直接感染肝脏,针对SARS-CoV的经皮肝活检显示明显的有丝分裂和细胞凋亡,并伴有非典型特征,如嗜酸小体(acidophilic body),肝细胞膨胀和小叶活动,但未发生纤维蛋白沉积和纤维化。
人们认为SARS相关的肝毒性可能与病毒性肝炎或与因高剂量服用抗病毒药物、抗生素和类固醇引起的药物毒性有关的继发性作用以及免疫系统反应过度有关。然而,对肝脏中2019-nCoV感染的了解很少。
令人吃惊的是,最近来自两个独立队列的单细胞RNA测序数据显示胆管细胞(占总细胞的59.7%)而不是肝实质细胞(占总细胞的2.6%)中的ACE2表达显著富集,这表明2019-nCoV可能导致肝内胆管直接遭受损伤。总之,应当付出很多努力来对COVID-19患者的初步消化道症状保持警惕,以便及早发现,早期诊断,早期隔离和早期干预。(生物谷 Bioon.com)
参考资料:
1.Jinyang Gu et al. COVID-19: Gastrointestinal manifestations and potential fecal-oral transmission. Gastroenterology, 2020, doi:10.1053/j.gastro.2020.02.054.
2.GI symptoms and potential fecal transmission in coronavirus patients
https://medicalxpress.com/news/2020-03-gi-symptoms-potential-fecal-transmission.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


