为何人类抗体能够应对各种病原体?两篇Nature揭示染色质环挤压导致V(D)J重组和抗体类别转换重组
来源:本站原创 2019-11-17 17:54
2019年11月17日讯/生物谷BIOON/---我们对抗遇到的众多潜在致病因子的能力取决于一种称为重组的过程,它可以以不同的方式发生,比如V(D)J重组和抗体类别转换重组(class-switch recombination, CSR)。这些重组过程操纵DNA序列,使我们的身体能够产生多种多样的免疫系统识别成分:抗体和T细胞受体(TCR)。如今,美国波士顿儿童医院的Frederick W. Al
2019年11月17日讯/生物谷BIOON/---我们对抗遇到的众多潜在致病因子的能力取决于一种称为重组的过程,它可以以不同的方式发生,比如V(D)J重组和抗体类别转换重组(class-switch recombination, CSR)。这些重组过程操纵DNA序列,使我们的身体能够产生多种多样的免疫系统识别成分:抗体和T细胞受体(TCR)。如今,美国波士顿儿童医院的Frederick W. Alt及其团队在Nature期刊上发表了的两篇论文揭示了这些类型的重组事件的发生方式存在意想不到的相似性。
在发育中的免疫系统细胞中,一种称为V(D)J重组的过程会使用三类称为V、D和J的基因片段重新排列DNA序列,从而组装将编码抗体或TCR的基因。这些基因片段的两侧是进化上保守的称为称为重组信号序列(RSS)的DNA序列,这些序列指示酶RAG以惊人的多样化组合方式将一个V片段和一个J片段,有时还包括一个D片段连接在一起。这些连接的基因片段之间的DNA通常会被删除,不过在极少数情况下,当两个基因片段连接在一起时,它发生倒置并保留下来。这种重组过程能够让抗体和TCR具有多样化的称为可变区(variable domain)的蛋白结构域,这些可变区识别称为抗原的蛋白片段。正是这些识别抗原的可变区的多样性使得免疫系统能够有效地应对各种致病因子。
这些编码抗体的基因有时会经历进一步的修饰,以改变单个DNA核苷酸碱基(产生所谓的体细胞点突变),从而增强抗体识别抗原的能力。这些基因中的DNA也可以经历一系列称为CSR重组的DNA改变,这些改变不影响抗原识别,相反,它们赋予抗体多种效应功能,比如结合粘膜表面的能力,或者有助于其他免疫细胞应对感染的能力。
V(D)J重组是由RAG启动的,而抗体编码序列中的体细胞点突变和CSR重组是由一种称为AID的DNA突变酶启动的。RAG和AID引起基因组广泛改变的潜在能力是危险的,因此它们的作用必须限于可利用DNA改变进行宿主防御的靶序列。
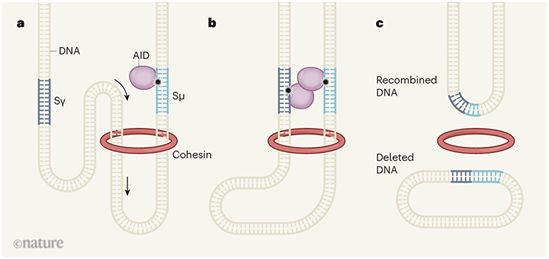
作为一种DNA-蛋白复合物,染色质紧密包装在人类细胞核内,形成成千上万个大小不一的环(loop),这些染色质环(或者说DNA环)通过一种称为黏连蛋白(cohesin)的蛋白复合物的环状结构(ring)锚定在它们的底部上。当黏连蛋白的分子马达组分通过黏连蛋白的环状结构主动挤压染色质直到染色质遇到了“障碍”时,这些染色质环就会形成。这可能是在染色质进入黏连蛋白环状结构之前或之时形成的,通常是在DNA与CTCF蛋白结合时形成的。对较大染色质环进行黏连蛋白依赖性挤压将染色质划分为离散的称为拓扑相关结构域(topologically associated domain)的区域,而较小的染色质环能够让DNA调控序列(比如位于线性DNA序列中相距较远的增强子和启动子)彼此相邻放置,从而驱动基因表达。Alt团队的这两篇论文表明染色质环挤压(chromatin-loop extrusion)也是控制V(D)J重组和CSR重组的基础(图1)。
在V(D)J重组过程中,RAG被招募到发生修饰的DNA结合组蛋白上,这些组蛋白较高水平地积累在含有抗体或TCR编码J基因的一个染色体小区域中。这将产生一个VDJ重组中心,在那里,RAG结合位于J基因片段两侧的RSS基序。然后,RAG以线性方式扫描其余的染色体,以找到另一个相距较远的基因片段的RSS基序。一旦两个兼容的RSS对齐后,RAG会诱导DNA断裂以启动这两个RSS之间的重组。RAG锚定在VDJ重组中心,这就引发了DNA在此扫描过程中如何移动的问题。
在第一篇论文中,Alt团队意识到染色质环挤压可能解释了这种DNA移动。在这种模型中,在黏连蛋白与结合RSS的RAG在VDJ重组中心组装后,黏连蛋白通过它的环状结构“缠绕”在DNA上,使得染色质环中的RSS可能找到与之相兼容的结合着RAG的RSS,以进行重组。这种模型得到了Alt团队开展的实验的支持,比如他们证实通过黏连蛋白环状结构阻止DNA的移动会使得重组事件发生偏向,从而有利于针对DNA移动受到阻止的位点附近的RSS进行重组。重要的是,这种模型中的定向DNA扫描机制还解释了在V(D)J重组过程中发生删除而非倒置事件的压倒性优势,长期以来这一直是一个无法解释的难题。鉴于这些实验与较早的研究一起证实黏连蛋白结合元件(位于某些抗体V基因片段附近的DNA基序)是DNA重排模式和由此产生的抗体库的主要决定因素,一种令人信服的模型出现了,即染色质环挤压有助于V(D)J重组。
CSR重组与V(D)J重组尽管在酶学上存在不同,但是在概念上是相似的。在第二篇论文中,Alt团队研究了黏连蛋白驱动的DNA环挤压是否也构成了CSR重组的基础。在CSR重组期间,AID在抗体编码基因的特定“转换区(‘switch region)”中引入了DNA核苷酸碱基的多点突变,这最终导致DNA断裂。不同于V(D)J 重组--- RAG介导的DNA切割依赖于一对相兼容的RSS的组装---的是,AID在单个DNA位点上引起突变,这些突变可导致DNA在转换区对齐之前或之后发生断裂,随后这些转换区连接在一起。
Alt团队提出,类似于在VDJ重组中心中发生的事件,CSR重组中心在抗体编码基因中的一个特定转换区(称为Sμ)上形成。先前的研究支持将扩散作为导致抗体类别转换过程中DNA对齐的机制,而Alt团队的研究工作支持基于黏连蛋白的染色质环挤压将两个转换区对齐而能够让它们进行重组的观点(图1)。因此,这两篇论文为V(D)J重组和CSR重组存在统一模型提供了令人信服的证据。它们还基于染色质结构的动态调节将这些过程与基因表达调控联系在一起。
这种模型提供了可待测试的预测,并提出了许多问题。比如,如何将黏连蛋白招募到VDJ重组中心和CSR重组中心?特定细胞谱系中的黏连蛋白剔除会导致有缺陷的V(D)J重组,而黏连蛋白的缺失消除了整个染色体上的所有染色质环。然而,这些改变对CSR重组的影响尚待确定。
染色质环挤压在DNA中产生扭转应力(torsional stress),而黏连蛋白招募酶拓扑异构酶IIB通过瞬时导致DNA断裂来缓解这种应力。因此,黏连蛋白缠绕DNA来调节基因表达或实现基于重组的免疫多样化可能驱动一种称为染色体易位的染色体异常,这可能导致癌症。就像DNA环本身一样,这些对染色体结构作用的新见解可能有助于揭示先前被认为是独立的领域之间存在的联系。(生物谷 Bioon.com)
参考资料:
1.Yu Zhang et al. The fundamental role of chromatin loop extrusion in physiological V(D)J recombination. Nature, 2019, doi:10.1038/s41586-019-1547-y.
2.Xuefei Zhang et al. Fundamental roles of chromatin loop extrusion in antibody class switching. Nature, 2019, doi:10.1038/s41586-019-1723-0.
3.Ferenc Livak et al. One ring to rule them all. Nature, 2019, doi:10.1038/d41586-019-03200-4.
在发育中的免疫系统细胞中,一种称为V(D)J重组的过程会使用三类称为V、D和J的基因片段重新排列DNA序列,从而组装将编码抗体或TCR的基因。这些基因片段的两侧是进化上保守的称为称为重组信号序列(RSS)的DNA序列,这些序列指示酶RAG以惊人的多样化组合方式将一个V片段和一个J片段,有时还包括一个D片段连接在一起。这些连接的基因片段之间的DNA通常会被删除,不过在极少数情况下,当两个基因片段连接在一起时,它发生倒置并保留下来。这种重组过程能够让抗体和TCR具有多样化的称为可变区(variable domain)的蛋白结构域,这些可变区识别称为抗原的蛋白片段。正是这些识别抗原的可变区的多样性使得免疫系统能够有效地应对各种致病因子。
这些编码抗体的基因有时会经历进一步的修饰,以改变单个DNA核苷酸碱基(产生所谓的体细胞点突变),从而增强抗体识别抗原的能力。这些基因中的DNA也可以经历一系列称为CSR重组的DNA改变,这些改变不影响抗原识别,相反,它们赋予抗体多种效应功能,比如结合粘膜表面的能力,或者有助于其他免疫细胞应对感染的能力。
V(D)J重组是由RAG启动的,而抗体编码序列中的体细胞点突变和CSR重组是由一种称为AID的DNA突变酶启动的。RAG和AID引起基因组广泛改变的潜在能力是危险的,因此它们的作用必须限于可利用DNA改变进行宿主防御的靶序列。
作为一种DNA-蛋白复合物,染色质紧密包装在人类细胞核内,形成成千上万个大小不一的环(loop),这些染色质环(或者说DNA环)通过一种称为黏连蛋白(cohesin)的蛋白复合物的环状结构(ring)锚定在它们的底部上。当黏连蛋白的分子马达组分通过黏连蛋白的环状结构主动挤压染色质直到染色质遇到了“障碍”时,这些染色质环就会形成。这可能是在染色质进入黏连蛋白环状结构之前或之时形成的,通常是在DNA与CTCF蛋白结合时形成的。对较大染色质环进行黏连蛋白依赖性挤压将染色质划分为离散的称为拓扑相关结构域(topologically associated domain)的区域,而较小的染色质环能够让DNA调控序列(比如位于线性DNA序列中相距较远的增强子和启动子)彼此相邻放置,从而驱动基因表达。Alt团队的这两篇论文表明染色质环挤压(chromatin-loop extrusion)也是控制V(D)J重组和CSR重组的基础(图1)。

图1.DNA环挤压导致抗体类别转换重组,图片来自Nature, 2019, doi:10.1038/d41586-019-03200-4。
在V(D)J重组过程中,RAG被招募到发生修饰的DNA结合组蛋白上,这些组蛋白较高水平地积累在含有抗体或TCR编码J基因的一个染色体小区域中。这将产生一个VDJ重组中心,在那里,RAG结合位于J基因片段两侧的RSS基序。然后,RAG以线性方式扫描其余的染色体,以找到另一个相距较远的基因片段的RSS基序。一旦两个兼容的RSS对齐后,RAG会诱导DNA断裂以启动这两个RSS之间的重组。RAG锚定在VDJ重组中心,这就引发了DNA在此扫描过程中如何移动的问题。
在第一篇论文中,Alt团队意识到染色质环挤压可能解释了这种DNA移动。在这种模型中,在黏连蛋白与结合RSS的RAG在VDJ重组中心组装后,黏连蛋白通过它的环状结构“缠绕”在DNA上,使得染色质环中的RSS可能找到与之相兼容的结合着RAG的RSS,以进行重组。这种模型得到了Alt团队开展的实验的支持,比如他们证实通过黏连蛋白环状结构阻止DNA的移动会使得重组事件发生偏向,从而有利于针对DNA移动受到阻止的位点附近的RSS进行重组。重要的是,这种模型中的定向DNA扫描机制还解释了在V(D)J重组过程中发生删除而非倒置事件的压倒性优势,长期以来这一直是一个无法解释的难题。鉴于这些实验与较早的研究一起证实黏连蛋白结合元件(位于某些抗体V基因片段附近的DNA基序)是DNA重排模式和由此产生的抗体库的主要决定因素,一种令人信服的模型出现了,即染色质环挤压有助于V(D)J重组。
CSR重组与V(D)J重组尽管在酶学上存在不同,但是在概念上是相似的。在第二篇论文中,Alt团队研究了黏连蛋白驱动的DNA环挤压是否也构成了CSR重组的基础。在CSR重组期间,AID在抗体编码基因的特定“转换区(‘switch region)”中引入了DNA核苷酸碱基的多点突变,这最终导致DNA断裂。不同于V(D)J 重组--- RAG介导的DNA切割依赖于一对相兼容的RSS的组装---的是,AID在单个DNA位点上引起突变,这些突变可导致DNA在转换区对齐之前或之后发生断裂,随后这些转换区连接在一起。
Alt团队提出,类似于在VDJ重组中心中发生的事件,CSR重组中心在抗体编码基因中的一个特定转换区(称为Sμ)上形成。先前的研究支持将扩散作为导致抗体类别转换过程中DNA对齐的机制,而Alt团队的研究工作支持基于黏连蛋白的染色质环挤压将两个转换区对齐而能够让它们进行重组的观点(图1)。因此,这两篇论文为V(D)J重组和CSR重组存在统一模型提供了令人信服的证据。它们还基于染色质结构的动态调节将这些过程与基因表达调控联系在一起。
这种模型提供了可待测试的预测,并提出了许多问题。比如,如何将黏连蛋白招募到VDJ重组中心和CSR重组中心?特定细胞谱系中的黏连蛋白剔除会导致有缺陷的V(D)J重组,而黏连蛋白的缺失消除了整个染色体上的所有染色质环。然而,这些改变对CSR重组的影响尚待确定。
染色质环挤压在DNA中产生扭转应力(torsional stress),而黏连蛋白招募酶拓扑异构酶IIB通过瞬时导致DNA断裂来缓解这种应力。因此,黏连蛋白缠绕DNA来调节基因表达或实现基于重组的免疫多样化可能驱动一种称为染色体易位的染色体异常,这可能导致癌症。就像DNA环本身一样,这些对染色体结构作用的新见解可能有助于揭示先前被认为是独立的领域之间存在的联系。(生物谷 Bioon.com)
参考资料:
1.Yu Zhang et al. The fundamental role of chromatin loop extrusion in physiological V(D)J recombination. Nature, 2019, doi:10.1038/s41586-019-1547-y.
2.Xuefei Zhang et al. Fundamental roles of chromatin loop extrusion in antibody class switching. Nature, 2019, doi:10.1038/s41586-019-1723-0.
3.Ferenc Livak et al. One ring to rule them all. Nature, 2019, doi:10.1038/d41586-019-03200-4.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


