Nature:揭示α-酮戊二酸是p53介导的肿瘤抑制的效应因子
来源:本站原创 2019-10-07 15:37
2019年10月7日讯/生物谷BIOON/---肿瘤抑制基因TP53(编码蛋白p53)在大多数人类癌症中以及在70%以上的胰腺导管腺癌(PDAC)中发生突变。野生型p53在细胞应激反应中积累,并调节基因表达以改变细胞命运和阻止肿瘤产生。众所周知,野生型p53也可以调节细胞代谢途径,不过人们对p53依赖性的抑制癌症进展的代谢变化仍然知之甚少。在一项新的研究中,来自美国纪念斯隆凯特琳癌症中心等研究机构
2019年10月7日讯/生物谷BIOON/---肿瘤抑制基因TP53(编码蛋白p53)在大多数人类癌症中以及在70%以上的胰腺导管腺癌(PDAC)中发生突变。野生型p53在细胞应激反应中积累,并调节基因表达以改变细胞命运和阻止肿瘤产生。众所周知,野生型p53也可以调节细胞代谢途径,不过人们对p53依赖性的抑制癌症进展的代谢变化仍然知之甚少。
在一项新的研究中,来自美国纪念斯隆凯特琳癌症中心等研究机构的研究人员发现p53重塑癌细胞代谢,从而促进染色质和基因表达发生有利于维持癌变前细胞命运(premalignant cell fate)的变化。在源自发生KRAS突变的PDAC小鼠模型的癌细胞中恢复p53功能导致α-酮戊二酸(αKG)积累,其中αKG也可作为一部分染色质修饰酶的专一性底物。相关研究结果近期发表在Nature期刊上,论文标题为“α-Ketoglutarate links p53 to cell fate during tumour suppression”。
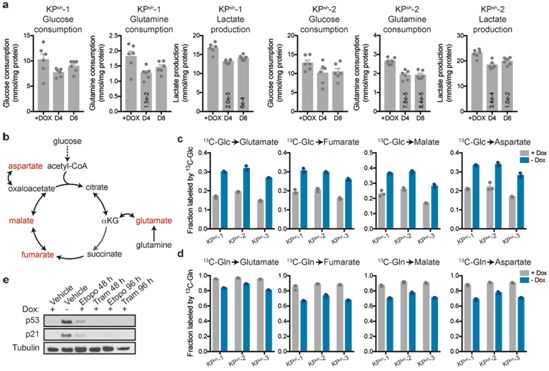
p53诱导了癌变前细胞分化特征性的转录程序,并且这种效果可通过添加细胞渗透性的αKG加以部分重现。作为一种αKG依赖性染色质修饰,5-羟甲基胞嘧啶(5hmC)的水平升高伴随p53触发的肿瘤细胞分化,而5hmC水平下降则表征了从癌前病变到去分化的恶性病变的转变,这与Trp53的突变有关。
通过抑制酮戊二酸脱氢酶(oxoglutarate dehydrogenase, 一种参与三羧酸循环的酶)来增强p53缺乏的PDAC癌细胞中的αKG积累,可以特异性地导致5hmC升高、肿瘤细胞分化和肿瘤细胞适应性下降。相反,增加细胞内的琥珀酸(αKG依赖性双加氧酶的一种竞争性抑制剂)水平会使p53驱动的肿瘤抑制作用减弱。
这些数据表明αKG是p53介导的肿瘤抑制的效应因子,并且αKG在p53缺陷型肿瘤中的积累可以驱动肿瘤细胞分化并抵抗恶性肿瘤进展。(生物谷 Bioon.com)
参考资料:
John P. Morris IV et al. α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature, 2019, doi:10.1038/s41586-019-1577-5.
在一项新的研究中,来自美国纪念斯隆凯特琳癌症中心等研究机构的研究人员发现p53重塑癌细胞代谢,从而促进染色质和基因表达发生有利于维持癌变前细胞命运(premalignant cell fate)的变化。在源自发生KRAS突变的PDAC小鼠模型的癌细胞中恢复p53功能导致α-酮戊二酸(αKG)积累,其中αKG也可作为一部分染色质修饰酶的专一性底物。相关研究结果近期发表在Nature期刊上,论文标题为“α-Ketoglutarate links p53 to cell fate during tumour suppression”。

图片来自Nature, 2019, doi:10.1038/s41586-019-1577-5。
p53诱导了癌变前细胞分化特征性的转录程序,并且这种效果可通过添加细胞渗透性的αKG加以部分重现。作为一种αKG依赖性染色质修饰,5-羟甲基胞嘧啶(5hmC)的水平升高伴随p53触发的肿瘤细胞分化,而5hmC水平下降则表征了从癌前病变到去分化的恶性病变的转变,这与Trp53的突变有关。
通过抑制酮戊二酸脱氢酶(oxoglutarate dehydrogenase, 一种参与三羧酸循环的酶)来增强p53缺乏的PDAC癌细胞中的αKG积累,可以特异性地导致5hmC升高、肿瘤细胞分化和肿瘤细胞适应性下降。相反,增加细胞内的琥珀酸(αKG依赖性双加氧酶的一种竞争性抑制剂)水平会使p53驱动的肿瘤抑制作用减弱。
这些数据表明αKG是p53介导的肿瘤抑制的效应因子,并且αKG在p53缺陷型肿瘤中的积累可以驱动肿瘤细胞分化并抵抗恶性肿瘤进展。(生物谷 Bioon.com)
参考资料:
John P. Morris IV et al. α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature, 2019, doi:10.1038/s41586-019-1577-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


