Nat Nanotechnol:浙江大学申有青课题组开发出新型纳米药物,可完全根除大约500立方毫米的肿瘤
来源:本站原创 2019-08-08 06:13
2019年8月8日讯/生物谷BIOON/---迄今为止,几种抗癌纳米药物已转化为临床试验,而且更多的抗癌纳米药物正在进行临床试验。然而,目前的困境是许多体系在动物模型中是有效的,但在临床试验中未能提高存活率。因此,这个领域的一个关键主题是如何进一步调整纳米药物的性质来提高它们的治疗功效。通常而言,在实体瘤中,为了将静脉注射的纳米药物递送至癌细胞的细胞质中,就必须克服CAPIR(circulatio
2019年8月8日讯/生物谷BIOON/---迄今为止,几种抗癌纳米药物已转化为临床试验,而且更多的抗癌纳米药物正在进行临床试验。然而,目前的困境是许多体系在动物模型中是有效的,但在临床试验中未能提高存活率。因此,这个领域的一个关键主题是如何进一步调整纳米药物的性质来提高它们的治疗功效。
通常而言,在实体瘤中,为了将静脉注射的纳米药物递送至癌细胞的细胞质中,就必须克服CAPIR(circulation, accumulation, penetration, internalization and release,即循环、积聚、渗透、内化和释放)级联事件中的一系列生物屏障,包括(1)血液中的循环;(2)肿瘤中的积聚;(3)深入渗透到无血管肿瘤组织中;(4)细胞内化和(5)细胞内药物释放。在这些生物屏障中,纳米药物渗透到肿瘤组织和来自血管的远端肿瘤细胞中仍然是一个尚未解决的障碍。
有限的纳米药物外渗到肿瘤组织中,升高的肿瘤间质液压力,紧密堆积的肿瘤细胞和致密的细胞外基质阻止从血管周围区域到远端细胞的分子扩散。尺寸高达100 nm的纳米药物甚至受到更多限制。比如,阿霉素脂质体(Doxil,即聚乙二醇化的阿霉素脂质体)具有比游离的阿霉素更高的肿瘤内积聚,因而在外渗时严重受限于血管周围区域,从而导致较低的疗效。调整纳米药物的大小和其他性质可以在一定程度上改善肿瘤渗透;然而,由于体积庞大的纳米药物通过致密的细胞外基质借助肿瘤间质液压力梯度进行的被动扩散保持不变,疗效通常仍然较低。
在一项新的研究中,在受到内皮细胞穴样内陷(caveolae)介导的转胞吞作用(transcytosis)的启发下,来自中国浙江大学、中国药科大学、北京化工大学和美国加州大学洛杉矶分校的研究人员提出除了通过增强渗透和滞留效应进行纳米药物被动积聚外,内皮细胞转胞吞作用可能会主动转运纳米药物穿过毛细血管壁进入肿瘤组织。此外,这种依赖ATP的转胞吞作用过程也可以绕过上面提及的被动扩散屏障,让纳米药物在整个肿瘤中积极渗透,从而到达远端细胞。
阳离子化可以有效地诱导吸附介导的转胞吞作用并促进纳米载体穿透多个细胞层。尽管阳离子电荷经常诱导调理作用和纳米药物从血液中快速清除,但是一种实现体内阳离子化触发的纳米药物渗透到肿瘤中的有效策略是在含有管腔的内皮细胞表面上或者在进入肿瘤血管周围之后,让纳米药物阳离子化,同时在血液循环期间保持纳米药物中性或略带阴离子。
虽然pH引发的电荷逆转已被用来让肿瘤中的纳米药物产生阳离子电荷,但是由于与管腔区室和血管周围区室相关的生理中性pH的存在,这种效果通常也是有限的。即使对于这些肿瘤区域,略带酸性的微环境通常与肿瘤血管网络相距100–200 μm。
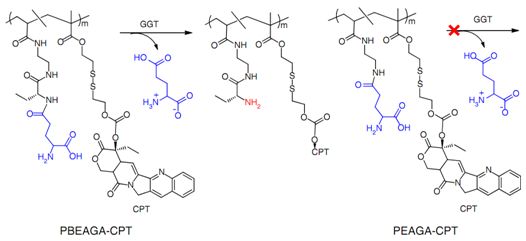
在各种人类肿瘤中,膜γ-谷氨酰转肽酶(GGT)在内皮细胞的外表面上和位于血管周围的代谢活跃的肿瘤细胞外表面中过表达。GGT切割γ-谷氨酰胺,因此已用于荧光探针和药物前体的肿瘤特异性激活。
在这项新的研究中,这些研究人员展示了一种具有较长血液循环时间的两性离子聚合物-药物偶联物(zwitterionic polymer–drug conjugate)。一旦接触肿瘤内皮细胞或者外渗到与肿瘤细胞接触的血管周围区域,这种偶联物遭受GGT介导的阳离子化,这就导致快速的穴样内陷介导的内吞作用和转胞吞作用,从而能够发生跨内皮和跨细胞转运,并且在整个肿瘤组织中相对均匀地扩散,因而显著提高治疗效果。相关研究结果近期发表在Nature Nanotechnology期刊上,论文标题为“Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy”。
这些研究人员证实GGT反应性阳离子化聚合物-药物偶联物(比如PBEAGA-CPT和PEAGA-CPT)通过癌细胞转胞吞作用进行活跃地肿瘤渗透,从而实现增强的抗癌疗效。特别地,GGT催化的PBEAGA-CPT阳离子化触发内皮细胞的转胞吞作用,从而导致癌细胞的快速外渗和有效的转胞吞作用,并因而导致PBEAGA-CPT高效地进行肿瘤渗透。因此,PBEAGA-CPT能够根除较大的大约500立方毫米的肿瘤,并且显著地延长携带原位胰腺瘤的小鼠的存活期。
这种生物反应性药物递送策略可能经进一步扩展后用于设计基于生理信号治疗多种疾病的治疗性聚合物。(生物谷 Bioon.com)
参考资料:
Quan Zhou et al. Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy. Nature Nanotechnology, 2019, doi:10.1038/s41565-019-0485-z.
通常而言,在实体瘤中,为了将静脉注射的纳米药物递送至癌细胞的细胞质中,就必须克服CAPIR(circulation, accumulation, penetration, internalization and release,即循环、积聚、渗透、内化和释放)级联事件中的一系列生物屏障,包括(1)血液中的循环;(2)肿瘤中的积聚;(3)深入渗透到无血管肿瘤组织中;(4)细胞内化和(5)细胞内药物释放。在这些生物屏障中,纳米药物渗透到肿瘤组织和来自血管的远端肿瘤细胞中仍然是一个尚未解决的障碍。

图片来自Nature Nanotechnology, 2019, doi:10.1038/s41565-019-0485-z。
有限的纳米药物外渗到肿瘤组织中,升高的肿瘤间质液压力,紧密堆积的肿瘤细胞和致密的细胞外基质阻止从血管周围区域到远端细胞的分子扩散。尺寸高达100 nm的纳米药物甚至受到更多限制。比如,阿霉素脂质体(Doxil,即聚乙二醇化的阿霉素脂质体)具有比游离的阿霉素更高的肿瘤内积聚,因而在外渗时严重受限于血管周围区域,从而导致较低的疗效。调整纳米药物的大小和其他性质可以在一定程度上改善肿瘤渗透;然而,由于体积庞大的纳米药物通过致密的细胞外基质借助肿瘤间质液压力梯度进行的被动扩散保持不变,疗效通常仍然较低。
在一项新的研究中,在受到内皮细胞穴样内陷(caveolae)介导的转胞吞作用(transcytosis)的启发下,来自中国浙江大学、中国药科大学、北京化工大学和美国加州大学洛杉矶分校的研究人员提出除了通过增强渗透和滞留效应进行纳米药物被动积聚外,内皮细胞转胞吞作用可能会主动转运纳米药物穿过毛细血管壁进入肿瘤组织。此外,这种依赖ATP的转胞吞作用过程也可以绕过上面提及的被动扩散屏障,让纳米药物在整个肿瘤中积极渗透,从而到达远端细胞。
阳离子化可以有效地诱导吸附介导的转胞吞作用并促进纳米载体穿透多个细胞层。尽管阳离子电荷经常诱导调理作用和纳米药物从血液中快速清除,但是一种实现体内阳离子化触发的纳米药物渗透到肿瘤中的有效策略是在含有管腔的内皮细胞表面上或者在进入肿瘤血管周围之后,让纳米药物阳离子化,同时在血液循环期间保持纳米药物中性或略带阴离子。
虽然pH引发的电荷逆转已被用来让肿瘤中的纳米药物产生阳离子电荷,但是由于与管腔区室和血管周围区室相关的生理中性pH的存在,这种效果通常也是有限的。即使对于这些肿瘤区域,略带酸性的微环境通常与肿瘤血管网络相距100–200 μm。
在各种人类肿瘤中,膜γ-谷氨酰转肽酶(GGT)在内皮细胞的外表面上和位于血管周围的代谢活跃的肿瘤细胞外表面中过表达。GGT切割γ-谷氨酰胺,因此已用于荧光探针和药物前体的肿瘤特异性激活。
在这项新的研究中,这些研究人员展示了一种具有较长血液循环时间的两性离子聚合物-药物偶联物(zwitterionic polymer–drug conjugate)。一旦接触肿瘤内皮细胞或者外渗到与肿瘤细胞接触的血管周围区域,这种偶联物遭受GGT介导的阳离子化,这就导致快速的穴样内陷介导的内吞作用和转胞吞作用,从而能够发生跨内皮和跨细胞转运,并且在整个肿瘤组织中相对均匀地扩散,因而显著提高治疗效果。相关研究结果近期发表在Nature Nanotechnology期刊上,论文标题为“Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy”。
这些研究人员证实GGT反应性阳离子化聚合物-药物偶联物(比如PBEAGA-CPT和PEAGA-CPT)通过癌细胞转胞吞作用进行活跃地肿瘤渗透,从而实现增强的抗癌疗效。特别地,GGT催化的PBEAGA-CPT阳离子化触发内皮细胞的转胞吞作用,从而导致癌细胞的快速外渗和有效的转胞吞作用,并因而导致PBEAGA-CPT高效地进行肿瘤渗透。因此,PBEAGA-CPT能够根除较大的大约500立方毫米的肿瘤,并且显著地延长携带原位胰腺瘤的小鼠的存活期。
这种生物反应性药物递送策略可能经进一步扩展后用于设计基于生理信号治疗多种疾病的治疗性聚合物。(生物谷 Bioon.com)
参考资料:
Quan Zhou et al. Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy. Nature Nanotechnology, 2019, doi:10.1038/s41565-019-0485-z.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


