Nature:揭示H+转运是线粒体ADP/ATP载体发挥功能所必需的一种功能
来源:本站原创 2019-07-30 17:02
2019年7月30日讯/生物谷BIOON/---一种称为线粒体的亚细胞结构是我们细胞的能量工厂。每天,人类需要身体产生ATP来为所有细胞活动提供能量。神经冲动、肌肉收缩、DNA复制和蛋白合成仅是依赖于ATP供应的至关重要的过程的一些例子。鉴于我们体内仅含有少量的ATP,我们需要使用位于线粒体中的一种称为ATP合酶(ATP synthase)的酶复合物,将ATP降解时产生的产物ADP(二磷酸腺苷)和
2019年7月30日讯/生物谷BIOON/---一种称为线粒体的亚细胞结构是我们细胞的能量工厂。每天,人类需要身体产生ATP来为所有细胞活动提供能量。神经冲动、肌肉收缩、DNA复制和蛋白合成仅是依赖于ATP供应的至关重要的过程的一些例子。
鉴于我们体内仅含有少量的ATP,我们需要使用位于线粒体中的一种称为ATP合酶(ATP synthase)的酶复合物,将ATP降解时产生的产物ADP(二磷酸腺苷)和磷酸盐重新转化为ATP。通过这种方式,每个ATP分子每天大约循环回收1300次。为了让ADP到达ATP合酶,并让重新产生的ATP为细胞提供能量,每个ADP/ATP分子必须穿过包围着线粒体的不可渗透的脂质膜。线粒体ADP/ATP载体(mitochondrial ADP/ATP carrier, AAC)参与线粒体中的ADP和ATP转运。
AAC在两种状态之间循环:在一种称为细胞质开放状态(cytoplasmic-open state)的状态下,它的中心结合位点可用于结合ADP,而在另一种称为基质开放状态(matrix-open state)的状态下,这种结合位点可用于结合新合成的ATP。
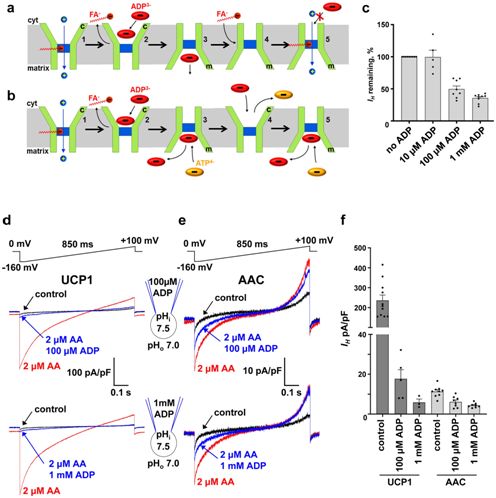
AAC是线粒体内膜的主要转运蛋白。它利用线粒体中的ATP交换细胞质中的ADP,并且控制细胞中的ATP产生。此外,人们已提出AAC介导线粒体解偶联(mitochondrial uncoupling),但是却难以证实这种功能或阐明它的作用机制。
在一项新的研究中,来自美国加州大学旧金山分校和哈佛医学院等研究机构的研究人员记录了直接来自各种小鼠组织的线粒体内膜的AAC电流,并鉴定出两种不同的转运模式:ADP/ATP交换和氢离子(H+)转运。相关研究结果发表在2019年7月25日的Nature期刊上,论文标题为“H+ transport is an integral function of the mitochondrial ADP/ATP carrier”。
AAC介导的H+电流需要游离脂肪酸,并且类似于通过在棕色脂肪中发现的产热解偶联蛋白1(uncoupling protein 1)发生的H+泄漏。AAC的ADP/ATP交换负向调节H+泄漏,但并没有完全抑制它。这表明H+泄漏和线粒体解偶联可能通过细胞的ATP需求和ADP/ATP交换速率来加以动态控制。
通过介导这两种不同的转运模式:ADP/ATP交换和H+泄漏,AAC将线粒体中的偶联能量转换(ATP产生)和解偶联能量转换(产热)相关联在一起。(生物谷 Bioon.com)
参考资料:
Ambre M. Bertholet et al. H+ transport is an integral function of the mitochondrial ADP/ATP carrier. Nature, 2019, doi:10.1038/s41586-019-1400-3.
鉴于我们体内仅含有少量的ATP,我们需要使用位于线粒体中的一种称为ATP合酶(ATP synthase)的酶复合物,将ATP降解时产生的产物ADP(二磷酸腺苷)和磷酸盐重新转化为ATP。通过这种方式,每个ATP分子每天大约循环回收1300次。为了让ADP到达ATP合酶,并让重新产生的ATP为细胞提供能量,每个ADP/ATP分子必须穿过包围着线粒体的不可渗透的脂质膜。线粒体ADP/ATP载体(mitochondrial ADP/ATP carrier, AAC)参与线粒体中的ADP和ATP转运。
AAC在两种状态之间循环:在一种称为细胞质开放状态(cytoplasmic-open state)的状态下,它的中心结合位点可用于结合ADP,而在另一种称为基质开放状态(matrix-open state)的状态下,这种结合位点可用于结合新合成的ATP。

图片来自Nature, 2019, doi:10.1038/s41586-019-1400-3。
AAC是线粒体内膜的主要转运蛋白。它利用线粒体中的ATP交换细胞质中的ADP,并且控制细胞中的ATP产生。此外,人们已提出AAC介导线粒体解偶联(mitochondrial uncoupling),但是却难以证实这种功能或阐明它的作用机制。
在一项新的研究中,来自美国加州大学旧金山分校和哈佛医学院等研究机构的研究人员记录了直接来自各种小鼠组织的线粒体内膜的AAC电流,并鉴定出两种不同的转运模式:ADP/ATP交换和氢离子(H+)转运。相关研究结果发表在2019年7月25日的Nature期刊上,论文标题为“H+ transport is an integral function of the mitochondrial ADP/ATP carrier”。
AAC介导的H+电流需要游离脂肪酸,并且类似于通过在棕色脂肪中发现的产热解偶联蛋白1(uncoupling protein 1)发生的H+泄漏。AAC的ADP/ATP交换负向调节H+泄漏,但并没有完全抑制它。这表明H+泄漏和线粒体解偶联可能通过细胞的ATP需求和ADP/ATP交换速率来加以动态控制。
通过介导这两种不同的转运模式:ADP/ATP交换和H+泄漏,AAC将线粒体中的偶联能量转换(ATP产生)和解偶联能量转换(产热)相关联在一起。(生物谷 Bioon.com)
参考资料:
Ambre M. Bertholet et al. H+ transport is an integral function of the mitochondrial ADP/ATP carrier. Nature, 2019, doi:10.1038/s41586-019-1400-3.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


