关于骨骼的这些秘密,你都知道多少?
来源:本站原创 2019-06-20 23:04
2019年6月20日讯 /生物谷BIOON /——骨骼是人体能够站立行走及一切动作的基础。那么关于你的骨骼,你了解多少呢?本期小编为大家盘点了关于骨骼的最新研究进展,帮助大家一起了解你身上的骨骼到底有何秘密?【1】eLife:"信使"细胞能够促进骨骼愈合DOI: 10.7554/eLife.40715骨骼如何愈合,它们怎么能愈合得更好?根据最近发表在eLife杂志上的USC干细胞研究,这些问题的答
2019年6月20日讯 /生物谷BIOON /——骨骼是人体能够站立行走及一切动作的基础。那么关于你的骨骼,你了解多少呢?本期小编为大家盘点了关于骨骼的最新研究进展,帮助大家一起了解你身上的骨骼到底有何秘密?
骨骼如何愈合,它们怎么能愈合得更好?根据最近发表在eLife杂志上的USC干细胞研究,这些问题的答案可能在于新发现的"信使"细胞群。在这项研究中,第一作者Stephanie T. Kuwahara和她的同事研究了哺乳动物的肋骨。通过观察小鼠中类似的肋骨手术,科学家们提出了一个关于哺乳动物如何修复大骨损伤的模型,并确定了治疗过程中必不可少的关键细胞类型。
这些关键细胞类型之一是一小群"信使"细胞,可通过称为Sox9的基因的活性来识别。这些信使细胞位于组织鞘中,称为骨膜,围绕每个肋骨。受伤后,一种名为"Hedgehog"的蛋白质会激活信使细胞,从而使相邻细胞分化为软骨和骨骼之间的杂交。这些杂交细胞形成"修复愈伤组织",其转化为新再生的骨。
科学家们还指出,虽然混合骨 - 软骨细胞在再生受伤的肋骨方面发挥着关键作用,但它们在胚胎发育期间最初形成的肋骨却令人惊讶地缺失。这使人们质疑许多生物学教科书中现有的教条:再生是对发展的重演。相反,再生和修复可能是它们自己独特的过程,涉及独特的细胞类型和遗传程序。
研究人员发现了小鼠体内一种新的转录因子可以帮助调节间充质干细胞(mesenchymal stem cells,MSCs)分化为骨的过程。目前科学家们对于骨细胞分化的研究并不深入,而MSCs则是再生医学领域一种很有潜力的干细胞来源。
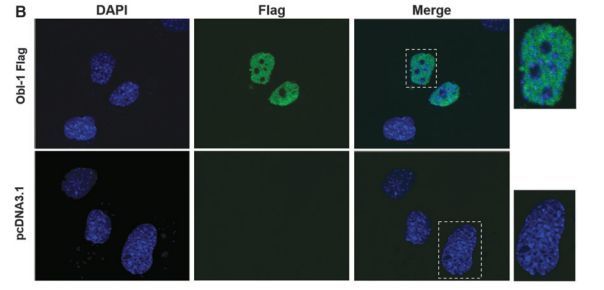
图片来源:Stem Cells and Development
这个新的转录因子叫做成骨细胞诱导因子1(Osteoblast Inducer 1,ObI-1),相关研究成果于近日发表在《Stem Cells and Development》上。这篇文章叫做"Identification of a Novel Transcription Factor Required for Osteogenic Differentiation of Mesenchymal Stem Cells",作者包括来自意大利那不勒斯大学费德里科二世的Francesca Querques和Anna DAgostino以及他们的同事,还有一组来自西班牙CRG基因调控中心的科学家。
研究人员在对MSCs进行筛查的时候发现了Obl-1,随后他们进行了深入研究,发现这个因子在一定程度上通过刺激BMP信号通路控制Runx2的表达来发挥作用。
在一项新的研究中,来自瑞典卡罗林斯卡学院等研究机构的研究人员报道小鼠的骨骼生长与血液、皮肤和其他组织产生新细胞的原理是一样的。这与之前认为骨骼生长依赖于有限数量的逐渐耗尽的祖细胞的认识相矛盾。如果这些新发现也适用于人类,那么它们可能会对治疗患有生长障碍的儿童做出重要贡献。相关研究结果发表在Nature期刊上。
儿童骨骼的生长取决于靠近身体所有长骨(long bone)末端的生长板(growth plate)。这些生长板由软骨细胞组成。这些软骨细胞产生一种支持新骨组织形成的支架,而它们本身是由称为软骨祖细胞(chondroprogenitor)的干细胞样祖细胞产生的。为了让长骨正常生长,软骨细胞必须在整个生长期内不断产生。这个领域的一般观点是在胚胎发育期间形成有限数量的祖细胞,它们随后用于骨骼生长,直到它们耗尽,人体才停止生长。为了确定是否确实如此,这些研究人员决定研究小鼠体内的软骨细胞形成。
这种祖细胞行为是不断产生新细胞的组织的典型表现,如皮肤、血液和肠道组织。对于这些类型的组织,人们已发现祖细胞位于一种非常特殊的微环境---干细胞壁龛(stem cell niche)---中,这种干细胞壁龛不仅产生必需的细胞(比如皮肤细胞和血细胞),而且也能够让这些祖细胞自我更新。如果这种干细胞壁龛受到破坏或者遭受功能障碍,那么这些祖细胞就会耗尽并且相应的组织就会受到破坏。这些研究人员如今证实至少在小鼠体内,生长板中也存在干细胞壁龛,如果这种局部的微环境受到破坏,骨骼生长就会停止,这意味着骨骼生长遵循着与科学家之前认为的完全不同的原则。
近日,一项刊登在国际杂志Nature Metabolism上的研究报告中,来自德国埃尔朗根-纽伦堡大学的科学家们通过研究发现了一种新型的血管网络或能将骨髓与骨膜中的血液供给直接连接起来。
尽管骨骼是一种非常坚硬的器官,但内部(骨髓)和外部(被骨膜所覆盖)均有致密的血管网络,这也就是为何骨折通常会诱发严重的出血,然而新的血细胞也可以通过血管系统离开骨髓而进入人类机体中。研究者Anika Grüneboom表示,与所有器官一样,骨骼也需要闭合的血液(血管)流动来维持基本的功能,当新鲜的血液通过动脉被运输到器官中时,静脉也会将"用过"的血液再次运输出去,目前研究者并未阐明闭合的血管在骨骼中的精确结构。

图片来源:tasnimnews.com
这项研究中,研究者在小鼠骨骼中发现了数千条此前未知的血管,其会垂直穿过致密骨骼组织(致密骨)的整个长度,研究人员将这种血管称之为"反式皮质血管"(TCVs),他们还发现,大部分的动脉和静脉血液会通过这种新发现的血管系统来流动,这就意味着,该系统是一种向骨骼供给氧气和营养物质的中枢组分。
此外,研究者还发现,骨髓中的免疫细胞会利用这种新型的血管系统来抵达血流中,在诸如关节炎等炎性疾病中,免疫细胞能到达机体炎性部位尤为重要;骨骼中的这种血管网络与机体中的其它运输系统相似。研究者Gunzer教授说道,此前的概念仅仅描述了骨骼中单一的动脉管和两个静脉管,这是完全不准确的,其也并不能反映实际的情况。后期研究人员还将继续深入研究深入阐明骨骼中的血管系统如何帮助免疫细胞快速有效抵达机体炎症病灶处。
最近一项研究中,约翰斯·霍普金斯大学医学研究人员在大鼠和人类细胞的实验中已经证明,可以控制在选定干细胞中驱动骨骼和脂肪形成的细胞蛋白质信号,以促进骨骼构建。他们认为,如果在人体中使用这种被称为WISP-1的蛋白质可以帮助骨折伤口更快愈合,加速手术恢复,并可能防止因衰老,损伤和紊乱导致的骨质流失。再生组细胞,统称为干细胞,都有可能发展成多种细胞类型,包括构成活组织的细胞类型,如骨骼。长期以来,科学家一直在寻找方法来操纵这些细胞的生长和发育路径,无论是在活体动物还是实验室中,以修复或替换因疾病或损伤而丢失的组织。
James指出,其他人以前的研究表明,特定类型的干细胞 - 血管周围干细胞 - 具有成为骨骼或脂肪的能力,从那时起,许多研究都集中在提高对信号蛋白驱动这一点的理解上。根据他自己的研究,詹姆斯也知道蛋白质WISP-1在指导干细胞方面起着关键作用。在他的新实验中,詹姆斯和他的团队通过基因工程从患者身上收集干细胞来阻断WISP-1蛋白的产生。观察没有WISP-1的细胞中的基因活性,他们发现导致脂肪形成的四个基因比含有正常水平的WISP-1蛋白的对照细胞高50-200%。
在他们的实验中,研究人员模仿了大鼠的人体外科手术,但此外,他们在融合的脊柱骨之间注射了WISP-1开启的人类干细胞。四周后,研究人员研究了大鼠的脊柱组织并观察到持续高水平的WISP-1蛋白。他们还观察到新骨形成,成功地将椎骨融合在一起,而没有用干细胞制作WISP-1的大鼠在研究人员观察期间没有显示任何成功的骨融合。
锻炼被吹捧为增强骨骼质量,但是它究竟如何实现这一点是一个有争议的问题。如今,在一项新的研究中,来自美国达纳-法伯癌症研究所和哈佛大学医学院的研究人员发现锻炼诱导的一种激素激活在小鼠骨骼重建中起着至关重要作用的细胞。相关研究结果发表在Cell期刊上。
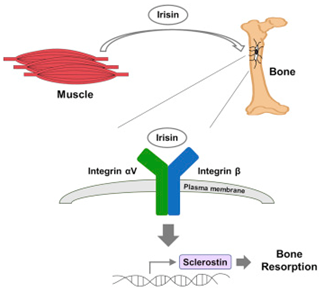
图片来源:Cell
这些研究人员鉴定出这种称为鸢尾素(irisin)的激素的受体---整合素αV,并且发现鸢尾素影响小鼠中的骨硬化蛋白(sclerostin),其中在人类中,骨硬化蛋白是骨骼结构的一种主要的细胞调节因子。这项研究有可能让人们在未来开发出新的骨质疏松症(osteoporosis)治疗方法。在全球,骨质疏松症每年导致890多万例骨折。
论文通讯作者、达纳-法伯癌症研究所癌症生物学家Bruce Spiegelman说,"这些结果有可能在代谢、肌肉骨骼生物学和锻炼领域引发变革。我们证实鸢尾素直接作用于骨细胞(osteocyte),即骨组织中一种最为丰富的细胞类型。" 哺乳动物的骨骼经历不断的重塑。旧有的或受损的骨骼被新细胞替换,这一过程通常始于现有骨细胞的死亡或破裂。锻炼---以及鸢尾素---都能激活骨硬化蛋白,其中骨硬化蛋白是当给骨骼施加机械应力时,由骨细胞分泌的一种骨骼破裂因子。
Spiegelman说,"间歇性骨骼破裂似乎被理解为一种增强和重塑骨骼的信号。关于这一点的概念验证已经存在,这是因为用于治疗骨质疏松症的甲状旁腺激素(PTH)也是一种骨骼破裂因子。" Spiegelman说,接下来的步骤将集中于优化不同版本的鸢尾素和鸢尾素抗体,"因此我们可能能够通过蛋白疗法来控制它的效果。我们正在研究它对脂肪组织和神经系统的影响"。
骨骼干细胞非常有价值,因为其能愈合很多类型的骨骼损伤,但研究人员却很多发现骨骼干细胞,因为他们并不知道骨骼干细胞的样子或者其存在的未知;近日,一项刊登在国际杂志Nature上的研究报告中,来自密歇根大学的科学家们通过研究在骨骺生长板(epiphyseal growth plate)的(resting zone)鉴别出了一类骨骼干细胞,骨骺生长板是一类特殊的软骨组织,其是骨骼生长的重要驱动子。
研究者Noriaki Ono表示,在静止区域发现骨骼干细胞非常有意义,因为研究人员普遍认为干细胞常常处于静息状态,直到其被需要时才会激活。为了寻找这种特殊类型的干细胞,研究者利用荧光蛋白来标记小鼠机体中的特殊细胞群体,随后随着时间延续来追踪这些细胞的命运变化,以这种方式,研究人员就能够研究这些细胞在天然状态下整个生命周期中的行为变化(并不仅仅是在培养皿中)。
研究者发现的这些特殊细胞能够满足骨骼干细胞的标准,因为其具有一些重要特性,即能够转变成为制造软骨和骨骼的细胞,还能够转化成为特殊细胞来支持血细胞的产生。研究者认为这种细胞可能只是其中一种骨骼干细胞;理解这些干细胞在生长板中发挥的重要功能或许能够帮助研究人员阐明为何某些患者会患上特殊类型的骨骼畸形或其它骨骼疾病等。
近期,美国斯坦福大学的研究人员在人类和小鼠体内鉴定出成体骨骼肌干细胞。类似于成年动物中存在的其他干细胞,骨骼肌干细胞具有有限的产生不同细胞类型的能力。具体而言,它们能够产生骨细胞、软骨细胞和基质细胞来修复诸如骨折之类的正常损伤。但是在牵拉成骨过程中,需要反复地让骨骼两端分隔得更远,因此这就需要更加广泛地骨再生。这种骨再生需要机械力,但是骨骼干细胞对这种环境信号如何作出反应仍然是未知的。
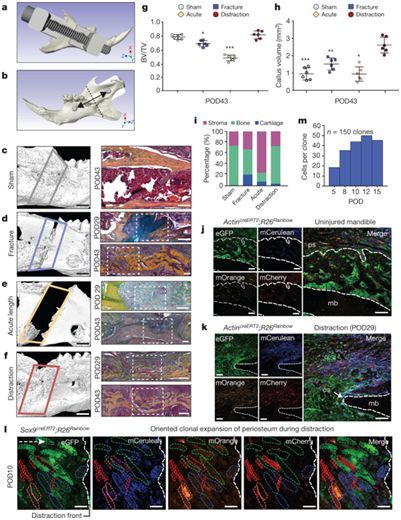
图片来源:Nature
在一项新的研究中,来自美国斯坦福大学的研究人员一种称为ATAC-seq的技术来鉴定小鼠骨骼肌干细胞在对机械牵拉力作出反应时启动的基因开关。他们发现这些干细胞开始表达通常在颅神经嵴细胞中发现的基因,其中颅神经嵴细胞是怀孕5到6周后出现的细胞,它们能够产生头部和面部中的骨骼、软骨和结缔组织。与此同时,这些干细胞抑制参与正常骨折修复所需的基因的表达。这意味着当需要再生大量的骨骼时,小鼠骨骼干细胞退回到一种在发育上更加灵活的状态。
这些发现首次表明在环境信号作出反应时,哺乳动物骨骼肌干细胞在一种称为去分化的过程中能够沿着发育时间轴向后移动,从而变得更加原始。特别值得一提的是,这些干细胞似乎非常类似于一种通常在人类怀孕后几周内出现的细胞类型,即颅神经嵴细胞。这些研究结果表明利用自然形成的仅有有限分化能力的成体干细胞在全身范围内实现更广泛的再生是有可能的。
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自瑞典卡罗琳学院的科学家们通过研究发现了一种新型罕见的骨骼疾病,文章中,研究人员描述了这种疾病发生的分子机制,同时他们还发现,一种小型的RNA分子在其中扮演关键角色,此前研究人员并未在先天性人类疾病中观察到这种特殊的RNA分子,本文研究结果对于受影响的患者非常重要,其还能帮助研究者理解其它的罕见疾病诊断技术。
这种新发现的骨骼疾病最初是在一个瑞典家庭的父母和孩子身上发现的,随后研究人员对患者开展了临床研究,并对患者进行了此前不同的诊断策略,研究人员确信这是一种此前并未发现的新型疾病。文章中,研究者表示,引发这种罕见骨骼疾病的原因是患者机体中MIR140基因的突变,该基因并不会产生蛋白质,而是会产生一种名为miR-140的microRNA分子,该分子能够调节其它基因的表达。
随后研究者开发出了患这种罕见骨骼疾病的小鼠模型,利用CRISPR-Cas9技术研究者开发出了携带MIR140突变的小鼠品系,随后他们观察到,小鼠的骨骼表现出了和上述患者相同的异常状况。此外研究者还发现,MIR140基因的突变会导致机体软骨生长板和长管状骨末端多个重要的基因出现异常表达,当被miR-140抑制的某些基因表达时,另外一些基因的表达就会被下调。
GSK的Wellcome Sanger研究所的科学家及其合作者分析了超过77,000名患有骨关节炎的人的基因组。近日在Nature Genetics上发表的研究结果揭示了与骨关节炎相关的新基因和生物学途径,这有助于确定新药的靶点。研究人员还强调了在骨关节炎中评估现有药物的机会。
来自桑格研究所的科学家,GSK分析了超过77,000名患有骨关节炎的人和超过370,000名健康人的全基因组。该团队研究了许多不同类型的骨关节炎,包括膝关节和髋关节。
为了发现哪些基因导致骨关节炎,该团队纳入了额外的功能基因组数据,并通过测量基因表达至蛋白质水平来分析基因活性。该团队将遗传和蛋白质组学数据整合到接受关节置换手术的患者组织中。通过整合许多不同的数据集,科学家们能够确定哪些基因可能是骨关节炎的原因。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


