巴黎大学:斑马鱼可作为细胞外小泡治疗发展的临床前模型
来源:生物谷 2021-06-08 10:07
近日,巴黎大学研究者在Advanced Drug Delivery Reviews杂志上发表了题为"Zebrafish as a preclinical model for Extracellular Vesicle-based therapeutic development"的文章。细胞外小泡(EV)在不同的病理生理过程中释放,反映其来源细胞的状态。一旦释
近日,巴黎大学研究者在Advanced Drug Delivery Reviews杂志上发表了题为"Zebrafish as a preclinical model for Extracellular Vesicle-based therapeutic development"的文章。细胞外小泡(EV)在不同的病理生理过程中释放,反映其来源细胞的状态。一旦释放,它们就可以通过生物液、靶细胞进行繁殖,传递其内容并引发功能性反应。这些特殊的特性将使它们成为生物标记物、药物纳米载体和治疗内源性调节剂。然而,由于缺乏对电动汽车在体内的行为的了解,它们潜在的治疗应用的进一步发展受到了阻碍。在活体成像EV领域的最新进展使得能够在高时空分辨率下对各种模式生物中的内源性和外源性EV进行活体追踪,以确定它们的分布、半衰期和命运。本文综述了目前可用于对EVS进行活体成像的成像工具,以及活体成像(特别是斑马鱼胚胎)如何能够进一步深入了解EVS的动力学、生物分布和功能,以促进其在治疗应用中的发展。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34058284/
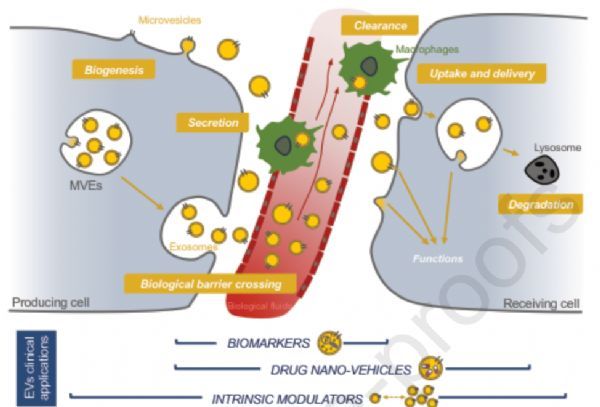
细胞外小泡(EVs)是一组异质的细胞来源的膜性结构,由所有类型的细胞分泌,这一过程在所有生物体中都是保守的。根据它们的亚细胞起源,它们可以分为两大类。胞外小体(直径30-150 nm)由内体小室产生和分泌,而微囊(直径50 nm-几?m)由质膜萌发。由于两个EV亚群都表现出重叠的组成和大小,因此术语EV在缺乏关于所讨论的囊泡的亚细胞起源的信息的情况下优先使用。EVS的生物学是复杂的,其生物发生、释放、摄取和进入靶细胞的命运仍不完全清楚。不同的分子机制,如ESCRT(运输所需的内体分选复合物)依赖和独立的分选机制,使EV在特定的蛋白质、脂质和核酸集合中富集。然而,EV的分泌也依赖于其他仍不明确的细胞内过程,这些过程调控细胞器运输、膜融合和溶酶体逃逸等。这些机制中的每一种的相对贡献可能因细胞类型和产生细胞的生理状态而不同,这妨碍了对EV生物发生过程的概括性描述。一旦释放,ev可以与其局部环境相互作用,或在各种生物液体中循环,并特别针对靠近分泌部位或远程器官的受体细胞,以引发功能性反应。通过携带和转移特定的货物,包括信号蛋白、代谢物和遗传物质,这些囊泡现在被认为是与各种生理病理过程有关的细胞间信使,包括神经元通讯、血液凝固、炎症或肿瘤发生以及其他关键的(病理)生理过程。EVS对特定细胞的靶向明显依赖于它们的表面组成,从而允许与受体细胞质膜上的受体结合。从那里,EVS可以作为细胞表面的信号实体,或者可以被内吞并靶向内体隔室。EVS与宿主细胞膜融合后,可在质膜或内吞体内直接将其内容释放到受体细胞的细胞质中。EV的所有这些不同特征都为它们在治疗应用中的应用带来了很高的希望。
现在越来越多的研究指出电动汽车在个性化医疗中作为临床工具的许多可行的应用。由于肠病毒的释放和含量可以在病理条件下改变,在生物液中发现的肠病毒可以提供有关分泌细胞状态的关键信息,增加它们作为监测疾病进展的潜在生物标志物的兴趣。EV的关键特性包括生物相容性和免疫原性差、跨越生物屏障的能力、靶向特定细胞类型和运送腔内内容物的能力等,使电动车成为理想的药物纳米载体。最后,EVS具有作为有害或有益的治疗调节剂的内在能力。因此,对它们的分泌或摄取进行积极或消极的调节将产生积极的治疗效果。
然而,EV提供的许多潜在治疗应用提高了人们的期望,面临着一些技术和翻译方面的挑战。由于EVS体积小,大多数EVS数据依赖于从液体活检或细胞培养上清液中提纯的混合异质EVS群体的分离。这种隔离和浓缩的最初步骤有一个重大缺陷,因为它抑制了有关EV起源和动态的资本信息,并忽视了它们分泌和传播的生理背景。同样,功能分析通常基于从体内环境中分离出来的EVS,随后以不同的浓度和频率给药,而忽略了EVS通常在体内遇到的复杂的结构和清除过程。因此,由于对EV在活体内的主要生理参数缺乏了解,基于EV的临床工具的进一步发展受到阻碍:EV是如何分泌、繁殖和到达靶细胞,还是在活体内被清除?这一差距主要是由于缺乏能够在保持单一EV分辨率的同时,在整个生物体范围内实时跟踪注射或内源性EV生命周期的模式生物。
斑马鱼(D.rerio)胚胎是一种很有前途的模型,它可以在囊泡尺度上以非侵入性的方式显示和跟踪EVS在活的脊椎动物多细胞生物体中的释放、转运途径和命运。由于斑马鱼胚胎体积小且透明,其单细胞精确度与线虫在脊椎动物系统中的研究相当,其结构与小白鼠和人类有相关的同源性。该模型允许非侵入性成像,非常适合于在高时空分辨率下对标记的EVS进行活体可视化。斑马鱼胚胎已经首先用于追踪EV biodistribution和评估的能力EVs穿过血脑屏障(BBB)的分辨率有限器官使用几个EVs用荧光标记的数量罗丹明123系统注入脑癌的典范。他们能够在高时空分辨率下追踪EVS,揭示体内肿瘤EVS在囊泡尺度上停止后的动态、血液循环中的行为和命运。斑马鱼胚胎也非常适合于相关的光学和电子显微镜(CLEM),它结合了活体追踪和电镜,用于体内EV命运的超微结构分析,例如EV在巡视巨噬细胞的晚期内质体/溶酶体中的积聚。使用注射外源性标记EVS的研究面临一些限制,因为它们依赖于注射大量EVS,而这些EVS不类似于局部生理分泌。此外,在分离过程中获得的一些污染物可以在体内(共)注射,在体内注射时,包括细胞来源、剂量和给药途径在内的许多因素都显示出影响evs生物分布的因素。因此,示踪EVS的原位释放将提供更多的生理信息。
探索EVS的体内生物学是进一步治疗应用的前提
图片来源:https://pubmed.ncbi.nlm.nih.gov/34058284/
总之,ev作为生物标志物、药物纳米载体或(病理)生理过程的内在调节剂,是开发创新治疗工具的一个重要领域。然而,有关ev在体内如何表现的基础知识有限,阻碍了临床试验的进一步发展。大多数关于EV特征的知识都是从转化的癌细胞和分离EV的异质群体的体外或体外研究中获得的,这导致了关于生物体EV生命周期动态的信息的丢失。为了阐明这一点,已经开发了几种标记和成像策略来跟踪ev,特别是在小鼠体内注射后。虽然这些方法可以评估EV的生物分布,但它们缺乏进一步的分辨率来更好地理解EV动力学,因为需要侵入性的活体内程序才能达到细胞规模。因此,内源性EV的生物发生、繁殖和功能的基本方面在很大程度上是未知的。斑马鱼似乎是一个相关的临床前模型,用于评估体内内源性或注射的EVS的生物学,因为它允许跟踪小泡,同时保留在整体成像尺度上。该模型能够实现高时空成像,以确定其生理和病理条件下的行为。斑马鱼胚胎的体内成像可以解开有关EV动力学在体内基本特征的技术和科学锁定,这对于进一步开发基于EV的治疗应用是必要的。(生物谷 Bioon.com)
参考资料
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->