2月Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2023-02-25 21:45
时间匆匆易逝,转眼间2月份即将结束,在即将过去的2月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间2月份即将结束,在即将过去的2月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:利用新开发的计算机软件确定在早期胚胎发育中发挥作用的基因
doi:10.1038/s41586-022-05688-9
近日,一篇发表在国际杂志Nature上题为“Dissecting cell identity via network inference and in silico gene perturbation”的研究报告中,来自美国华盛顿大学医学院等机构的科学家们通过研究开发的计算机软件可以预测当个别基因缺失或受到过多激活时,复杂的基因网络会发生什么。此类基因网络在早期胚胎发育中发挥着关键作用,指导干细胞形成特定的细胞类型,然后构建组织和器官。绘制这些网络中单个基因的作用,是了解健康发育和寻找再生受损细胞和组织的方法的关键。同样地,了解基因错误可以使人们了解出生缺陷、流产甚至癌症。
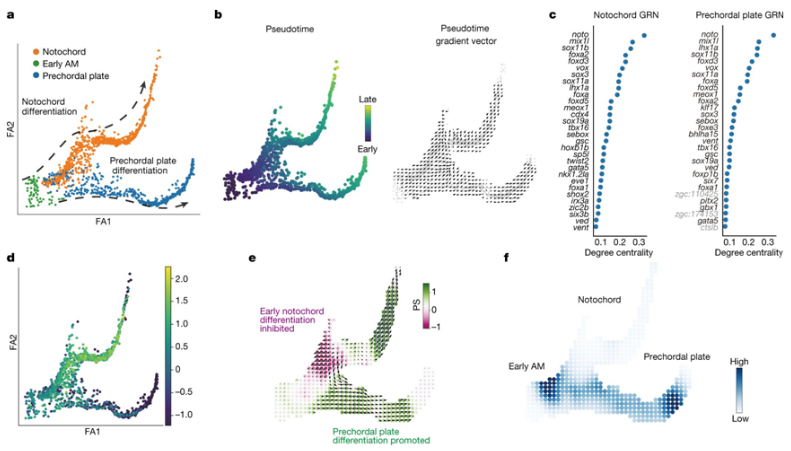
利用斑马鱼胚胎发生数据进行CellOracle KO模拟
图片来源:Nature, 2023, doi:10.1038/s41586-022-05688-9。
这类遗传实验---通常是在实验室里的动物模型(如小鼠和斑马鱼)中进行---几十年来一直是发育生物学研究的支柱。在基因缺失或过度表达的动物研究中,可以了解到很多关于基因的功能,但这些实验也是昂贵和耗时的。相比之下,这种新开发的名为CellOracle的开源软件可以在几分钟内建立数百个遗传实验模型,帮助科学家们识别在发育中发挥重要作用的关键基因,然而这些基因可能被旧的、较慢的技术所忽略。
研究者Samantha A. Morris博士表示,科学界已经从动物实验中收集了足够多的数据,我们如今可以做的不仅仅是观察生物学的发生---我们可以构建基因如何相互作用的计算机模型,并预测当一个基因缺失时会发生什么。我们可以在没有任何实验干预的情况下做到这一点。一旦我们确定了一个重要的基因,我们仍然需要做实验室实验来验证这一发现。但这种计算方法可以帮助科学家们缩小哪些基因是最重要的。CellOracle是一些相对较新的软件系统之一,旨在对细胞基因调控进行建模。CellOracle不是简单地识别基因网络,它的独特之处在于能够让人们测试一个基因网络当以特定方式受到破坏时会发生什么。
【2】Nature:揭示细菌中的泛素转移酶启动抗病毒免疫反应机制
doi:10.1038/s41586-022-05647-4
近日,一篇发表在国际杂志Nature上题为“An E1–E2 fusion protein primes antiviral immune signalling in bacteria”的研究报告中,来自美国科罗拉多大学博尔德分校等机构的科学家们通过研究发现当涉及到抵御入侵者时,细菌的运作方式与人类细胞极为相似,它们拥有开启和关闭免疫途径所需的相同核心分子机制。他们还揭示了这种共享的古老分子机制---一群称为泛素转移酶(泛素转移酶)的酶---是如何运作的。他们说,更好地了解并有可能重新编程这种分子机制,最终可能为治疗一系列人类疾病(从类风湿性关节炎和克罗恩病等自身免疫性疾病到帕金森病等神经退行性疾病)的新方法铺平道路。
研究者Aaron Whiteley博士表示,这项新的研究表明,我们与细菌没有什么不同。通过研究这些细菌过程,我们可以学到很多关于人体如何发挥作用的知识。”这项新的研究并不是第一次展示细菌可以教给人类的东西。越来越多的证据表明人类免疫系统的一部分可能起源于细菌,而且在植物和动物王国中,进化产生了更复杂的细菌抗病毒工具。
2020年,美国加利福尼亚大学伯克利分校生物化学家Jennifer Doudna因CRISPR获得了诺贝尔奖,这是一种基因编辑工具。细菌利用CRISPR来对抗噬菌体。围绕CRISPR的讨论点燃了科学界对蛋白和酶在抗噬菌体免疫反应中所发挥的作用的新兴趣。Whiteley说,“在过去的三到五年里,人们已意识到它不会随着CRISPR而结束。它的潜力是如此之大。”在这项新的研究中,Whiteley和论文共同第一作者Jane Coffin Childs与加州大学圣地亚哥分校的生物化学家合作,进一步了解一种名为cGAS(环状GMP-AMP合酶)的蛋白,人们以前已发现它既存在于人类中,也以一种更简单的形式存在于细菌中。在细菌和人类中,当细胞感觉到病毒入侵时,cGAS对于启动下游防御至关重要。但是在细菌中是什么在调节这个过程,以前是不知道的。
【3】Nature:重大发现!揭示一种修复神经元DNA损伤的新策略
doi:10.1038/s41586-023-05711-7
不使用它就会失去它”,这句格言被广泛地应用于从我们的肌肉到我们的头脑的一切,特别是随着我们的年龄增长。然而,当涉及到大脑时,这种使用并不完全是一件好事:虽然使用脑细胞可能确实有助于在整个生命中保持记忆和其他认知功能,但是科学家们已发现,相关活动也会损害神经元,使它们的DNA出现更多的断裂。这就提出了一个问题:神经元如何在一生中在大脑中执行重要工作时保持健康和功能?
如今,一篇发表在国际杂志Nature上题为“A NPAS4–NuA4 complex couples synaptic activity to DNA repair”的研究报告中,来自美国哈佛医学院等机构的科学家们通过研究发现了一种新的DNA修复机制,它只发生在神经元中,而神经元是人体中一些寿命最长的细胞。这项在小鼠身上进行的研究,有助于解释为什么神经元在高强度的重复工作中仍能长期发挥功能。具体而言,他们的研究结果显示,一种名为NPAS4-NuA4的蛋白复合物启动了一种修复神经元活动诱发的DNA断裂的途径。
研究者Elizabeth Pollina博士表示,后期我们还需要进行更多的研究,但我们认为这是一种非常有希望的机制,可以解释神经元如何长期保持它们的寿命”。如果这些发现在进一步的动物研究中得到证实,然后在人类身上得到证实,它们可能有助于科学家们了解大脑中的神经元在衰老或神经退行性疾病中出现功能障碍的精确过程。在身体的众多细胞类型中,神经元是与众不同的:与大多数其他细胞不同,它们不会再生或复制。日复一日,年复一年,它们不知疲倦地工作,对环境线索进行自我重塑,确保大脑能够在一生中适应和运作。
doi:10.1038/s41586-022-05682-1
近日,一篇发表在国际杂志Nature上题为“Aberrant phase separation and nucleolar dysfunction in rare genetic diseases”的研究报告中,来自德国柏林夏里特医学院等机构的研究人员详细研究了BPTA综合征这种极其罕见的遗传性疾病是如何产生的。他们发现一种蛋白的电荷变化破坏了细胞的自我组织,从而导致了这种发育障碍。他们还确定了数百种与多种疾病(比如大脑发育障碍和癌症易感性)相关的可比较的基因变化。这一发现可能是众多无法解释的疾病和健康状况的原因。
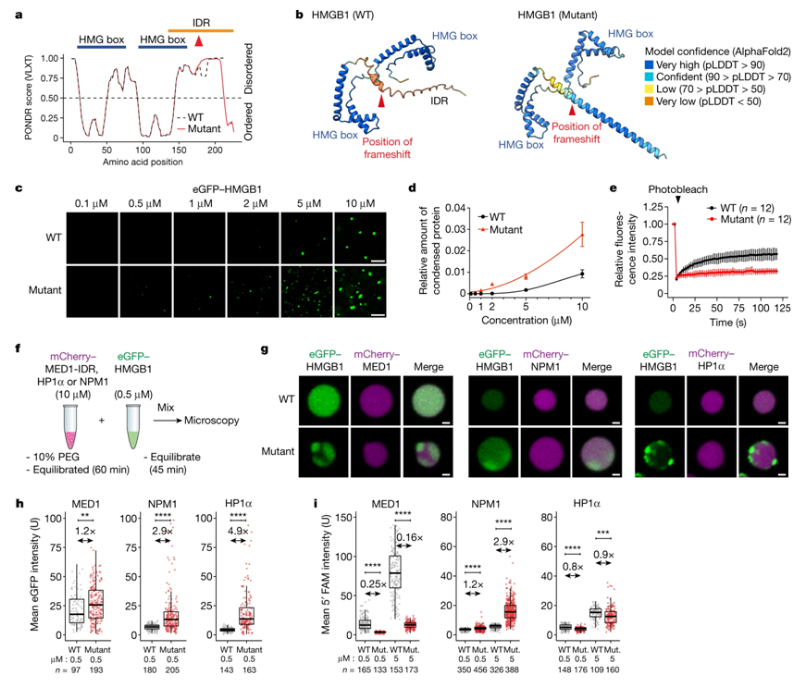
导致BPTA综合征的移码突变改变体外的HMGB1相分离
图片来源:Nature, 2023, doi:10.1038/s41586-022-05682-1。
数以千计的基因变化与多种疾病、发育障碍和状况有关。但是,这些突变究竟是如何产生疾病的,却很少清楚。这是因为这些变化涉及到具有无序三维结构的蛋白片段以及迄今为止所知甚少的细胞内功能。研究者Martin Mensah博士表示,很难研究这些类型的蛋白片段负责做什么,因为在许多情况下,它们必须与其他分子相互作用才能产生其效果。以BPTA综合征为例,我们如今详细描述了蛋白的无序区域中的变化如何导致一种遗传疾病。”这意味着这些作者发现了一种导致遗传性疾病的新机制---而且,根据这项新的研究,这种机制毕竟不是那么罕见。
BPTA是“brachyphalangy, polydactyly and tibial aplasia/hypoplasia(指骨缩短、多指畸形和胫骨增生/发育不全)”的缩写。患者有严重的畸形,影响到四肢、面部、神经系统和骨骼,以及其他器官。全世界有记载的病例不到十个,因此这种疾病极为罕见。为了确定这种综合征的病因,这些作者对五名受影响患者的遗传信息进行了解码,发现所有患者的HMGB1蛋白都发生了变化。由于所谓的移码突变(frameshift mutation),该蛋白结构的最后三分之一携带正电荷,而不是通常的负电荷。
【5】Nature:三种机体衰老的标志:端粒、线粒体和炎症或能相互协作来预防癌症发生
doi:10.1038/s41586-023-05710-8
随着机体年龄的增长,染色体的端粒会逐渐变短;近日,一篇发表在国际杂志Nature上题为“Telomere-to-mitochondria signalling by ZBP1 mediates replicative crisis”的研究报告中,来自索尔克研究所等机构的科学家们通过研究发现,当端粒变得非常短时,其就会与细胞中的线粒体相互交流,从而就会诱发一系列复杂的信号通路并开启炎性反应,进而破坏原本可能发生癌变的细胞。相关研究结果有望帮助开发新方法来预防并治疗癌症,同时还能帮助设计更好的干预措施来抵消衰老所诱发的有害后果。
文章中,研究人员通过联合研究探索了他们各自在炎性信号通路中所得到的发现的相似性,研究者Karlseder等人对端粒生物学特征进行了研究并揭示了端粒是如何预防癌症形成的,而Shadel等人则研究了线粒体在人类疾病、衰老和免疫系统中所扮演的关键角色。Karlseder说道,我们非常激动能发现端粒和线粒体之间的对话,它们在控制良好的生物学过程中能协同作用来启动杀灭促进癌症的细胞的特殊细胞通路。
当端粒缩短到无法继续保护染色体免受损伤的程度时,“危机”过程就会发生,这时细胞就会死亡;这种有益的自然过程能移除携带较短端粒且基因组不稳定的细胞,同时也能形成抵御癌症发生的强大屏障,此前研究人员发现,处于危机中的细胞会被一种称之为自噬的过程所移除,而在这一过程中,机体会清除受损的细胞。这项研究中,研究人员就想知道在端粒极短的危机时刻,自噬依赖性的细胞死亡程序是如何被激活的,通过利用称之为成纤维细胞的人类皮肤细胞进行遗传筛查,科学家们发现,相互依赖的免疫感知和炎性信号通路(类似于免疫系统对抗病毒的通路)对于危机期间的细胞死亡至关重要,具体而言,他们发现,较短端粒所发出的RNA分子或能以一种独特的方式来激活线粒体外表面名为ZBP1和MAVS的免疫感应器。
【6】Nature:新发现!肿瘤自身的代谢过程或许要比预想中更慢!
doi:10.1038/s41586-022-05661-6
科学家们从来都并不确切地知道在哺乳动物机体中癌变的肿瘤到底会消耗多少能量,他们假设癌细胞会消耗大量能量,并搅动营养物质,使得诸如心脏、肝脏和胰腺等健康器官处于一种不利的状态,因为代谢系统会扩散营养。然而,近日一篇发表在国际杂志Nature上题为“Slow TCA flux and ATP production in primary solid tumours but not metastases”的研究报告中,来自普林斯顿大学等机构的科学家们通过研究首次发现,事实或许恰恰相反,即肿瘤将营养物质转化为可用的细胞能量的过程会明显且可量化地减缓。这种“昏睡”(lethargy)行为或许能帮助肿瘤为其更邪恶的行为来保存能量,比如生长和转移等。
在5种不同类型的癌症中,研究者发现,肿瘤会在低能量的环境中成功增殖,部分是因为其忽略了健康器官为整个机体的利益而发挥的正常组织功能。这一研究发现对于新型抗癌疗法的开发意义重大,因为其能将注意力引向缓慢的能量代谢。一些针对癌症患者的治疗建议会围绕“饿死肿瘤”的策略,假设没有营养物质的话,肿瘤就无法生长,而从能量基质的一般角度来看,这种策略充其量是值得怀疑的。但研究人员确实发现,肿瘤要比正常组织更会利用一种特殊的营养物质,即葡萄糖,因此这符合将标准癌症疗法与减少机体葡萄糖循环的饮食进行结合的可能性,比如生酮饮食等。
研究者Caroline Bartman表示,我认为人们假设癌症需要很多能量的话,因为其必须支付细胞分裂和增殖的“费用”,但并没有人真正测定过与机体健康器官相比癌症会制造和使用多少能量。为此,研究人员开发了一种测定方法,并发现了肿瘤和其它组织之间的巨大差异,如今研究人员拥有了一种范式,即癌症是非常节约的,其会停止将能量用于机体所有的健康任务,而是将其用于增殖,这或许就告诉我们,诸如饿死癌症等类型的途径以及单独的治疗策略或许并不是最好的。
【7】Nature:通过降低结合亲和力来增强特殊抗癌抗体的疗效
doi:10.1038/s41586-022-05673-2
近日,一篇发表在国际杂志Nature上题为“Reducing affinity as a strategy to boost immunomodulatory antibody agonism”的研究报告中,来自南安普顿大学等机构的科学家们通过研究发现,改变抗体与靶点结合的紧密程度或能改善癌症疗法的疗效。
抗体能检测并标记病毒和细菌以便机体免疫系统能摧毁它们,为了帮助预防机体的二次感染,我们机体的免疫系统就能微调这些抗体从而使其对这些靶点有更为紧密的控制力,即所谓的高亲和力(higher affinity)。癌症免疫疗法能采用相同的改变,直接靶向作用抗体使其被设计从而来寻找并紧密结合癌细胞,从而使得免疫系统能杀灭癌细胞,在过去几年里,这些抗体疗法被证明能成功治疗某些癌症,但很多癌症患者仍然并不会产生反应且会对疗法产生一定的耐受性。
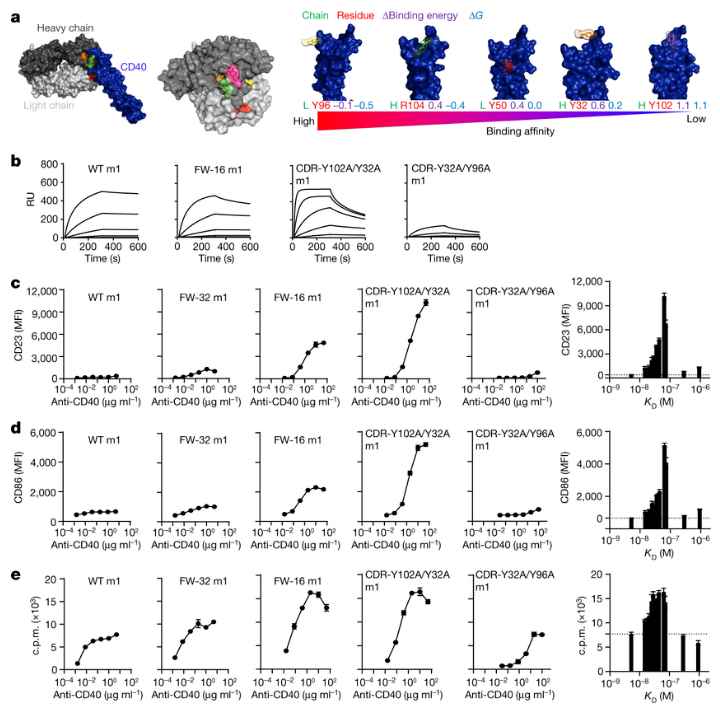
通过降低结合亲和力来增强特殊抗癌抗体的疗效。
图片来源:Nature (2023). DOI:10.1038/s41586-022-05673-2
这项研究中,研究人员通过研究发现,一种名为“免疫调节性抗体”(immunomodulatory antibodies)的不同类型治疗性抗体在其具有较松的结合力时或能成功治疗癌症。改变结合的松紧程度被称之为亲和力工程学研究,研究人员认为其能提供一种高效更为灵活的机会来治疗癌症。免疫调节性抗体能结合免疫细胞上而并非肿瘤细胞上的受体,并能通过改变传递给免疫细胞的信号来促使其更加活跃并更好地杀灭癌细胞。这项研究中,研究人员分析了三种独立的受体:CD40, 4-1BB和PD-1,结果发现,当结合稍松时,受体就会更好地聚集,而且传递到免疫细胞中的信号也会得到改善,对于其中的CD40受体而言,其能表现出对肿瘤更好的杀伤力。研究者Mark Cragg说道,尽管获批的抗体药物的数量在持续不断增加,且目前有100多种已经进入了临床试验,但一些患者仍然对疗法没有反应,因此,开发出新型策略通过注入亲和力工程学技术来给抗体进行超级增压或许就是为患者提供更好疗法的关键。
【8】Nature:我国科学家领衔揭示叶绿体TOC-TIC超级复合物的三维结构
doi:10.1038/s41586-023-05744-y
藻类和植物的叶绿体是通过光合作用将太阳能转换成化学能的细胞引擎。这种细胞器由两层膜包裹,含有自己的基因组,其表达与细胞核基因组的表达紧密协调。大多数叶绿体蛋白是由细胞核基因编码的,在细胞质中翻译成前体蛋白,这些前体蛋白的氨基末端有一种转运序列,作为进入叶绿体的入场券。蛋白进入叶绿体是由它的外膜和内膜中的两种膜蛋白复合物介导的,这两种复合物分别称为TOC(Translocon on the Outer Chloroplast membrane,叶绿体外膜转运子)和TIC(Translocon on the Inner Chloroplast membrane,叶绿体内膜转运子)。这两种复合物在叶绿体的生物发生、光合器组装和多种代谢途径中起着关键作用。TOC和TIC的不同蛋白亚基已被鉴定和表征,TOC和TIC已被发现共同形成一种超级复合物。然而,TOC和TIC的不同蛋白如何组装在一起而形成跨越叶绿体包膜的蛋白转运通道还不清楚,而且TOC和TIC内部的蛋白转运途径仍然难以理解。
近日,一篇发表在国际杂志Nature上题为“Architecture of chloroplast TOC-TIC translocon supercomplex”的研究报告中,来自中国科学院生物物理研究所等机构的科学家们通过研究对一种名为莱茵衣藻(Chlamydomonas reinhardtii)的单细胞绿藻的TOC-TIC超级复合物的分子成分、三维结构和潜在的蛋白转位途径提供了期待已久的见解。这些作者通过低温电镜阐明了TOC-TIC超级复合物的超分子结构。在这种超级复合物中发现了13种不同的蛋白亚基。除了由叶绿体基因组编码的Tic214外,所有其他的蛋白亚基都是由细胞核编码的。它们被组装成外膜TOC复合物、膜间空间复合物(intermembrane space complex, ISC)和内膜TIC复合物。值得注意的是,他们发现最大的膜蛋白Tic214横跨内膜、膜间空间和外膜,像桥梁一样将其他蛋白亚基连接起来,很可能还充当支架。
外膜中的TOC复合物主要由Toc34、Toc90和Toc75组成,Toc90一侧为Ctap4-Ctap3复合物。外膜上的Toc90和Toc75形成一种杂合桶状通道。这种杂合桶状通道包含一个位于细胞质一侧的入口和两个向膜间空间开放的出口,以及一个面向脂质双层的侧门。植酸(也称为六磷酸肌醇,简称InsP6)分子插在Toc90和Tic214之间的界面上,像一个楔子一样稳定它们的组装。
【9】Nature:破解50年谜团 科学家揭示mRNA Cap2甲基化对细胞的抗病毒防御至关重要
doi:10.1038/s41586-022-05668-z
近日,一篇发表在国际杂志Nature上题为“mRNA ageing shapes the Cap2 methylome in mammalian mRNA”的研究报告中,来自美国威尔康奈尔医学院等机构的科学家们通过研究发现了信使RNA(mRNA)含有对细胞的抗病毒防御至关重要的化学标记,这一发现解开了50年来有关这些化学修饰的目的之谜,并表明错误的mRNA修饰可能是一些自身免疫和炎症疾病的基础。
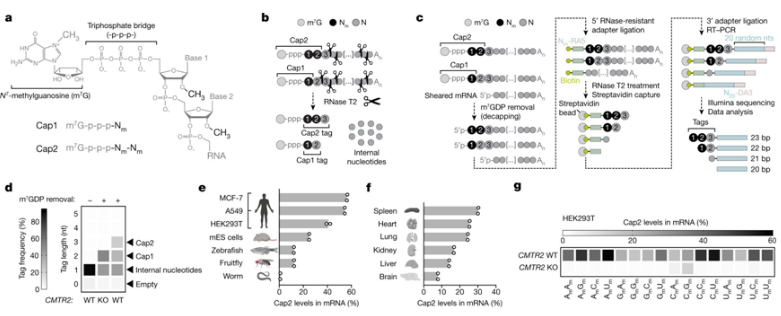
Cap2是在不同序列环境中发现的可变mRNA修饰
图片来源:Nature, 2023, doi:10.1038/s41586-022-05668-z。
具体而言,他们发现在mRNA分子上的一个特定位点存在的一种常见的化学修饰---甲基化---为mRNA提供了额外的保护,使得它免受抗病毒免疫机制的破坏。研究者Samie Jaffrey博士表示,我们从20世纪70年代起就知道,甲基修饰在某种程度上是mRNA正常发挥作用的基础。因此,最终对它确切的作用有了这样的了解,非常令人高兴。
mRNA是由活跃的基因复制而来,它们将表达蛋白的指令从细胞核中的DNA向外传递到细胞的主要部分---细胞质,在那里它们被翻译成蛋白。Jaffrey实验室研究了细胞用来调节mRNA的机制---比如,促进或抑制它们翻译成蛋白的机制。其中的一种调节机制是在mRNA中加入化学修饰。这些化学修饰通常涉及甲基修饰。在以前的研究工作中,Jaffrey团队开发了检测这些甲基修饰之一---甲基腺苷(m6A)---的方法,这种甲基修饰控制细胞中的mRNA稳定性。m6A的改变可以导致不同类型的癌症。
【10】Nature:衰老细胞会终生损害身体 去除衰老细胞有助于抗衰老
doi: 10.1038/s41586-022-05535-x
长期以来,衰老一直被认为是不可避免的,但随着抗衰老研究的进展,预防衰老的治疗越来越被认为是可行的。有趣的是,在抗衰老治疗中,“衰老细胞”无疑是最引人注目的。这些衰老细胞已经停止了分裂,并且看起来处于生长停滞的休眠状态。更致命的是,衰老细胞会持续存在并不断分泌许多促炎和组织重塑分子而毒害周围其他细胞。因此,如果能将这些衰老细胞从体内分离出来,也许就能缓解衰老的进程甚至是逆转衰老。
近日,一篇发表在国际杂志Nature上题为“Senescence atlas reveals an aged-like inflamed niche that blunts muscle regeneration”的研究报告中,来自中国科学院广州生物医药与健康研究等机构的科学家们通过研究提出了一种从小鼠身上分离衰老细胞的方法,并证明这些衰老细胞会引起炎症,甚至在幼年小鼠身上也会阻止骨骼肌再生。这项研究进一步证实了去除衰老细胞有助于对抗衰老的观点。
衰老细胞只占身体的一小部分,即使在老年人中也是如此,但它们通过一种称为衰老相关分泌表型(SASP)的过程分泌信号蛋白,从而对机体造成重大损害。SASP诱导纤维化,例如组织增厚和瘢痕,并阻断健康细胞的正常功能。因此,衰老细胞被认为会导致许多疾病和衰老的不良副作用。这些副作用包括肌肉减少症——一种与年龄相关的骨骼肌质量和功能下降,即衰老的骨骼肌被脂肪和纤维组织取代而无法自我修复。相比之下,健康的年轻骨骼肌即使在受伤后也具有显著的再生能力。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


