2024年HIV研究进展第1期
来源:生物谷原创 2024-01-25 10:06
HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
生物谷小编梳理了一下近期生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Science:新研究表明要成功开发有效的HIV疫苗,可能需要促进CD8+T细胞产生的强烈的免疫反应
doi:10.1126/science.adg0514
在一项新的研究中,来自美国国家过敏与传染病研究所(NIAID)的研究人员发现有效的HIV疫苗可能需要促使称为CD8+T细胞的免疫细胞产生强烈反应,以保护人们免受HIV病毒感染。他们比较了过去的HIV疫苗研究参与者和即使在没有抗逆转录病毒疗法(ART)的情况下也能自然阻止HIV复制的HIV感染者---通常称为长期无进展者(long-term non-progressor, LTNP)或精英控制者(elite controller, EC)---的免疫系统活性。相关研究结果发表在2023年12月15日的Science期刊上,论文标题为“HIV vaccines induce CD8+ T cells with low antigen receptor sensitivity”。

图片来自Science, 2023, doi: 10.1126/science.adg0514
当 HIV 进入人体后,这种病毒通过侵入 CD4+ T 细胞开始破坏免疫系统,其中CD4+ T 细胞是一种白细胞,有助于协调人体对病原体的免疫反应。在大多数人体内,除非通过ART加以控制,否则HIV会继续复制并损害越来越多的 CD4+ T 细胞。在 LTNP/EC中,免疫系统似乎能迅速识别携带 HIV 的 CD4+ 细胞,并激活称为 CD8+ T 细胞的免疫细胞。CD8+ T 细胞会消灭携带HIV的 CD4+ 细胞,从而抑制血液中的HIV。
有效的HIV疫苗旨在提供对HIV的持久保护性免疫力,或者如果最初的防御被绕过,则帮助长期控制体内的HIV,正如LTNP/EC中的那样。虽然有几种候选预防性HIV疫苗被设计成能刺激 CD8+ T 细胞活性,但在临床试验中它们并不能阻止HIV感染或控制病毒复制。了解和解决这种缺乏效果的问题是HIV疫苗研究的科学重点。
这些作者设计了他们的研究,以更好地了解以前的HIV疫苗接种者缺乏哪些 CD8+ T 细胞功能。他们将以前的 HIV 疫苗研究参与者的实验室样本与来自LTNP/EC的样本进行了比较。他们发现,HIV 疫苗接种者和 LTNP/EC都产生了大量能识别 HIV 的 CD8+ T 细胞。然而,与来自LTNP/EC的 CD8+ T 细胞不同的是,HIV 疫苗接种者的 CD8+ T 细胞无法提供必要的蛋白来消灭感染 HIV 的 CD4+ T 细胞。
进一步的测试表明,这种反应减弱的原因是疫苗接受者的 T 细胞受体---CD8+ T 细胞检测携带HIV 的 CD4+ T 细胞的部分---对 HIV 的敏感性降低。T细胞受体敏感性的降低表明,之前几项研究中的候选疫苗并没有充分刺激CD8+ T细胞的成熟,从而无法识别、到达并消灭人体内所有携带HIV的CD4+ T细胞。
2.Nature:科学家揭示HIV结合宿主机体T细胞的又一奥秘
doi:10.1038/s41586-023-06762-6
HIV-1感染是由病毒包膜糖蛋白(Env)与细胞表面受体CD4结合而开启的,尽管目前研究人员已经确定了Env与CD4可溶性结构域复合体的高分辨率结构,但其在天然膜中的结合过程研究人员尚不清楚。近日,一篇发表在国际杂志Nature上题为“HIV-1 Env trimers asymmetrically engage CD4 receptors in membranes”的研究报告中,来自耶鲁大学医学院等机构的科学家们通过研究首次揭示了HIV与T细胞膜上的受体结合的关键步骤,这一研究发现或有望帮助开发治疗HIV感染的新型疗法。
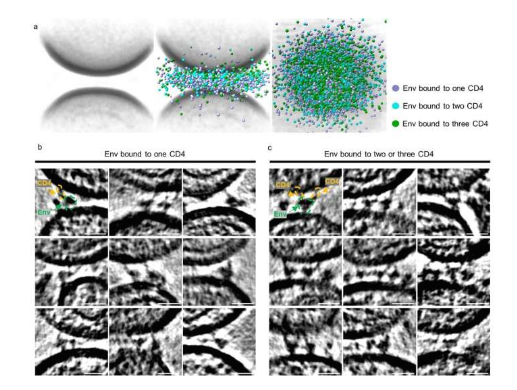
科学家揭示HIV结合宿主机体T细胞的又一奥秘。图片来源:Nature (2023). DOI:10.1038/s41586-023-06762-6
目前并没有针对HIV的疫苗或治疗性手段,抗逆转录病毒疗法(ART)能帮助HIV感染者将病毒抑制到无法检测到的水平,但这些患者必须终生服药来控制病情,对于一些患者而言,药物的有效性会随着时间的推移而减弱,如今科学家们知道,HIV能首先通过结合名为CD4的细胞表面受体来感染宿主机体。利用一种称之为低温电子断层扫描(cryo-ET,cryogenic electron tomography)的技术,研究人员首次可视化地观察到了HIV-1如何与携带CD4受体的病毒样颗粒(VLP)相互作用,相关研究揭示了HIV-1和VLP膜蛋白之间的逐步相互作用,包括HIV-1与宿主结合的中间阶段的结构。
研究人员发现了HIV-1和VLP会聚集形成小簇并形成环状结构,当膜结构被分开地更远的时候,HIV-1就会只与CD4结合,当细胞膜靠近时,HIV-1就能与第二个和第三个CD4分子结合,研究人员认为,这三个中间步骤代表了HIV如何自然地与T细胞上的CD4结合。此前研究人员工程化设计了HIV在与一个活两个CD4受体分子结合时的构象状态的原子模型,但他们并不清楚是否这一模型会自然存在,本文对真实膜结构的研究就表明事实的确如此。
通过制造能靶向作用HIV中间构象的抑制剂,研究人员希望在HIV感染宿主细胞之前对此进行干预,这样他们就有一个时间窗口,或许就能特异性地利用抗体和药物来靶向作用这些构象状态,研究人员的目标就是阻断HIV,且并不干预对细胞有益的其它分子。研究者表示,我们可以将HIV想象成为在道路上“奔跑”的流氓汽车,阻断的药物能阻断车道从而抑制病毒扩散,但其也会影响路上的其它车辆,于是研究人员目前正在了解病毒的外观(包括颜色、大小和形状),这样就能利用药物专门特异性地对其靶向作用了,且能在不影响其它车辆的情况下将病毒拉到一边。
3.Nature:新研究揭示HIV-1包膜蛋白异源三聚体与CD4结合时的中间构象
doi:10.1038/s41586-023-06639-8
人类免疫缺陷病毒(HIV)是一种可怕的病原体。它变异迅速;事实上,据估计,在某一时刻,一个人体内HIV的遗传多样性相当于全球一年的流感病毒多样性。此外,HIV还产生了保护自身的结构,使自己不被抗体和药物识别和攻击。这些因素都导致HIV成为一种危险、难以治疗的病毒。
科学家们对HIV如何感染宿主细胞的生物过程了解得越多,就越能设计出更好的治疗方法来穿透这种病毒的防御系统并消灭它。如今,在一项新的研究中,来自美国加州理工学院的研究人员在原子尺度上对一种难以捉摸的HIV蛋白结构进行了成像。相关研究结果于2023年11月22日在线发表在Nature期刊上,论文标题为“Intermediate conformations of CD4-bound HIV-1 Env heterotrimers”。
HIV的包膜蛋白是“三聚体”,类似于三脚架状的花朵:它有三个“茎(stem)”部分,每个茎部分称为 gp41,此外还有三个“花瓣(petal)”区域,称为 gp120。为了启动感染,三个 gp120 蛋白都会抓住 T 细胞表面上一种叫做 CD4 的受体。一旦三个 CD4 受体被三个 gp120 蛋白抓住,它们就会暴露出被宿主辅助受体识别的位点,然后该包膜蛋白的茎部分就会出现一种针状结构,从而使得这种病毒能够感染并进入人体细胞。
但如果HIV包膜蛋白的 gp120“花瓣”只能抓住一两个 CD4 受体呢?这时该包膜蛋白还能完全打开,让这种病毒感染细胞吗?了解这一过程可能会对设计药物产生重大影响。如果能够阻止一两个 CD4 受体被 gp120 抓住,这是否就足以阻止感染?为了回答这个悬而未决的问题,这些作者试图在只有一两个CD4受体被gp120结合的情况下对HIV包膜蛋白进行成像。
对这些结构进行成像是一项挑战:由于生化原因,在试管中制造“异源三聚体”或只与一个或两个 CD4 受体结合的包膜蛋白并不容易。通过一种创新的工程方法,这些作者设计出了一种构建稳定异源三聚体的方案。然后,他们利用Fan在低温电镜这一精细实验流程方面的专长,拍摄了与 CD4 受体结合的脆弱HIV包膜蛋白异源三聚体的结构图像。
这些结构显示如果只有一个或两个CD4受体被HIV包膜蛋白结合,该包膜蛋白就无法完全打开并经历与感染相关的形状改变过程。Dam说,“这项新研究提出的一个主要问题是:不能完全开放的包膜蛋白还能促进感染吗?”
4.Nat Commun:科学家揭示T细胞在机体感染HIV的免疫反应所发挥的作用机制
doi:10.1038/s41467-023-42435-8
近日,一篇发表在国际杂志Nature Communications上题为“CD8+ T cells control SIV infection using both cytolytic effects and non-cytolytic suppression of virus production”的研究报告中,来自Fred Hutchinson癌症研究中心等机构的科学家们通过研究将计算机模型与对猕猴的实验进行结合后发现,机体的免疫系统在很大程度上能通过抑制已感染细胞中的病毒产生来帮助控制机体HIV的感染,同时也能杀死被病毒感染的细胞,但仅在细胞感染开始时的一个狭窄的时间窗口内可以发挥作用。

科学家揭示T细胞在机体感染HIV的免疫反应所发挥的作用机制。图片来源:Nature Communications (2023) DOI:10.1038/s41467-023-42435-8
研究者Ruy M. Ribeiro说道,为了消灭HIV,我们就必须理解机体的免疫系统是如何尝试控制器感染的;文章中,我们设法对感染了SIV的猕猴进行实验来验证我们新开发的模型,SIV在猴子中的感染方式与HIV在人类机体感染的方式相同。实际上,免疫系统并不能消除HIV的感染,但确定现有的在某种程度上控制HIV的机制对于设计增强这一机制的治疗方法非常重要,如果研究人员能调节免疫系统来帮助更好地控制HIV,他们或许就能在某种程度上治疗这种疾病。
研究人员重点关注了由CD8+ T细胞所介导的免疫反应,从而就有望解决HIV研究中悬而未决的相关问题,即这些T细胞到底是通过杀死HIV感染的细胞还是诱发人类细胞部署抵御感染的防御机制来控制HIV的?关于这类T细胞通过杀死被感染的细胞来控制感染,还是通过某种控制病毒而不是杀死被感染的细胞,目前仍存在一定的争议,所以研究人员就试图区分这些可能性和机制。答案就是,两者兼而有之。
为了分离T细胞的作用,研究者Los Alamos等人运行了这一模型来预测利用抗体和抗病毒药物对感染的猕猴群体进行不同治疗的效果;一些猕猴接受了药物治疗,这些药物旨在通过阻断病毒整合到猕猴细胞的DNA中来阻断病毒感染细胞,这种名为整合酶抑制剂的药物能揭示病毒生命周期早期部分的动态,而这是我们利用其它类型疗法无法轻易观察到的,就好像我们使用显微镜一样。另外一些猕猴揭示了能剔除CD8+ T细胞的抗体进行治疗,这种抗体能消除CD8+ T细胞在抵御感染中的作用;而第三组猕猴则接受了两种疗法。
随后研究人员运行了这种模型来分析猕猴的数据,从而就确定了不同免疫反应的影响效应,基于模型,他们就能推断出最相关的免疫机制,并能更接近地描述所观察到的数据。综上,本文研究结果表明,CD8+ T细胞在病毒整合之前对感染细胞具有细胞溶解效应,并且能通过抑制病毒的产生来发挥一种直接的非细胞溶解效应。
5.Cell Rep Med:揭示特殊抗体保护机体抵御HIV感染背后的分子机制
doi:10.1016/j.xcrm.2023.101201
靶向作用HIV-1 Env的中和性抗体如今已经被证明能保护 机体抵御全身性感染。近日,一篇发表在国际杂志Cell Reports Medicine上题为“HIV-1 neutralizing antibodies provide sterilizing immunity by blocking infection of the first cells”的研究报告中,来自德国波鸿大学等机构的科学家们通过研究发现,HIV抗体或能通过抑制第一个细胞的感染来提供消除性免疫作用(sterilizing immunity)。
这项研究中,研究人员开发出了一种基于猿猴免疫缺陷病毒(SIV)的挑战性病毒,这些病毒仅会利用HIV的包膜蛋白来穿透第一个细胞,随后其会进行切换且仅利用SIV的包膜蛋白,在基于动物实验的研究中,研究人员将这些挑战性病毒暴露于选定的HIV抗体中;这些被选择的抗体只会与HIV上的包膜蛋白进行结合,但并不与来自SIV的包膜蛋白结合,在动物实验中,HIV抗体就能通过直肠的粘膜来阻断病毒的感染,而且在粘膜中存在足够的抗体,其能在粘膜中阻断第一个细胞发生HIV感染。
这种消除性免疫(完全能提供保护抵御感染)对于HIV而言尤为重要,其能确保受感染的细胞最初不会形成病毒蛋白,即使其携带有病毒的基因组,数年后,当机体的抗体水平下降时,这些潜伏的感染细胞就会重新激活病毒仍然引起感染。最后,研究者表示,这项研究中所使用的抗体目前仍然处于临床开发阶段,但在获批后,其就能作为一种非常有希望的方法来保护个体抵御HIV的感染。
6.Nat Med:新研究表明研究人员在治愈HIV感染方面又迈出了一大步
doi:10.1038/s41591-023-02547-6
如今,HIV感染可以通过药物治疗得到控制。然而,尽管经过 40 年的深入研究,科学家们仍未找到治愈这种疾病的方法。HIV感染者在停止治疗几周后,这种病毒就会反弹。但是,如今,在一项新的研究中,来自丹麦奥胡斯大学和挪威奥斯陆大学等研究机构的研究人员可能又向当今数百万艾滋病病毒感染者的无药生存迈进了一步。相关研究结果于2023年9月11日在线发表在Nature Medicine期刊上,论文标题为“Impact of a TLR9 agonist and broadly neutralizing antibodies on HIV-1 persistence: the randomized phase 2a TITAN trial”。
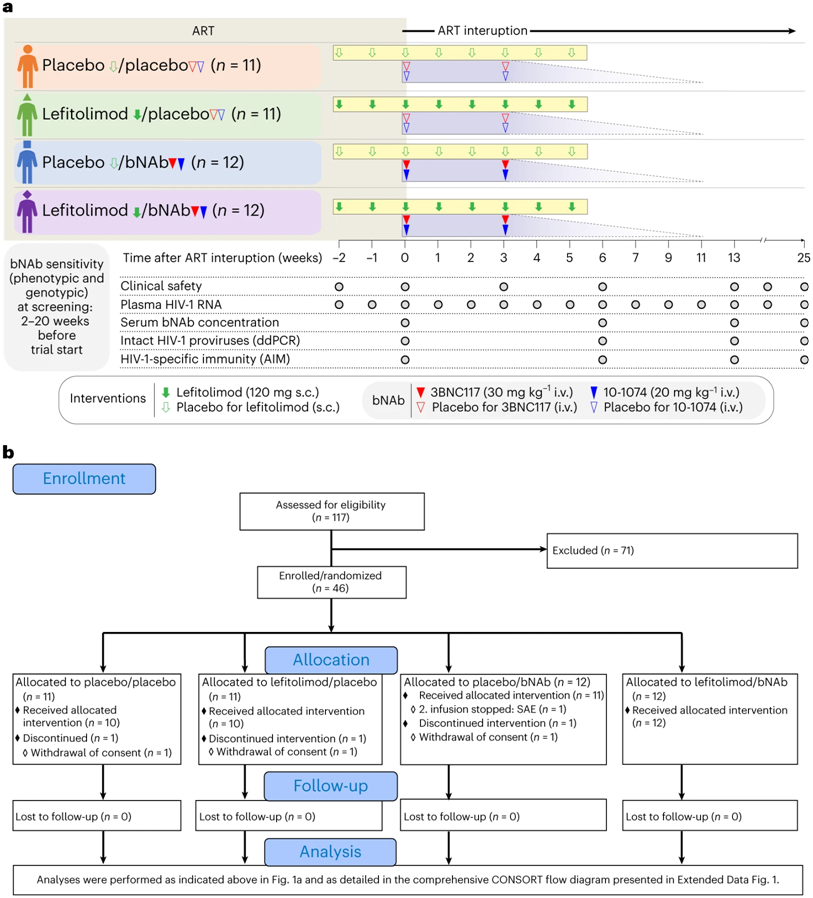
临床试验设计流程。图片来自Nature Medicine, 2023, doi:10.1038/s41591-023-02547-6
在这项新的研究中,这些作者发现已经接受治疗多年的HIV感染者也能从这种疗法中获益。具体来说,这种抗体治疗可使研究参与者抑制HIV超过三个月。一些参与者在停止常规艾HIV治疗后,仍能自发抑制这种病毒超过 18 个月。
论文通讯作者、奥胡斯大学临床医学系的 Ole Schmeltz Søgaard 教授希望新发现能让我们离治愈HIV感染更近一些:“这项研究是首次在人体上进行的安慰剂对照临床试验之一,我们在这项临床试验中展示了一种提高人体自身抗击HIV的能力的方法---即使在标准治疗中止的情况下。因此,我们认为这项研究是向治愈迈出的重要一步。”
7.两篇Cell子刊发现在抗逆转录病毒治疗期间,感染者体内休眠的HIV可产生病毒RNA和蛋白
doi:10.1016/j.chom.2023.08.006; doi:10.1016/j.chom.2023.08.012
HIV抗逆转录病毒疗法(ART)被认为是一种治疗方法,而不是一种治愈方法,因为患者通常会携带有感染HIV的细胞库,如果停止治疗,HIV就会重新出现。长期以来,人们一直认为这种细胞库处于休眠状态,但是在两项新的研究中,两个独立的研究团队报告说,这种细胞库中有一部分细胞会自发产生HIV RNA 和蛋白,从而可能会影响患者的HIV特异性免疫反应。相关研究结果发表在2023年9月13日的Cell Host & Microbe期刊上,论文标题分别为“Spontaneous HIV expression during suppressive ART is associated with the magnitude and function of HIV-specific CD4+ and CD8+ T cells”和“An active HIV reservoir during ART is associated with maintenance of HIV-specific CD8+ T cell magnitude and short-lived differentiation status”。

图片来自Cell Host & Microbe, 2023, doi:10.1016/j.chom.2023.08.006
第一篇论文通讯作者、瑞士洛桑大学医院免疫病毒学者Daniel Kaufmann说,“这是一种具有欺骗性的休眠病毒。即使在接受治疗的人群中,HIV仍有一定的活性,并继续与免疫系统相互作用。我们必须了解这些持续的相互作用是否会产生临床相关的后果。”
Kaufmann团队发现,这18 名患者中有 14 人体内感染HIV的细胞库自发产生病毒 RNA。这18 名患者中有 7 人体内感染HIV的细胞库还产生病毒蛋白,包括 p24,其中p24是 HIV 外壳的一个组成部分。Kaufmann说,“残留在体内的大部分HIV都是有缺陷的,或者是不能真正增殖的垃圾病毒,但我们发现这些有缺陷的病毒仍能产生病毒 RNA,有时还能产生蛋白。”
在第二篇论文中,来自美国俄勒冈健康与科学大学的研究人员也报告说,在ART治疗期间,一部分 CD4+ T 细胞会自发表达病毒 RNA,特别是在急性感染而不是慢性感染时开始治疗的泰国参与者队列中。急性HIV感染者体内的病毒蛋白较少,但是这两组感染者(急性HIV感染者和慢性HIV感染者)的免疫反应相似。第二篇论文通讯作者为俄勒冈健康与科学大学疫苗与基因治疗研究所免疫学者Lydie Trautmann。
Trautmann及其研究团队写道,“我们的研究表明,ART疗法中活跃的HIV感染细胞库所导致的残余免疫功能障碍,可能会阻碍可产生高效快速免疫回忆反应的功能性干细胞样可自我更新的HIV特异性CD8+ T细胞的分化,从而导致分析性治疗中断后的HIV控制不力。” (生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


