2021年11月Science期刊不得不看的亮点研究
来源:本站原创 2021-11-30 23:58
2021年11月30日讯/生物谷BIOON/---2021年11月份即将结束了,11月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:组织干细胞维持不同的表观遗传记忆机制doi:10.1126/science.abh2444组织干细胞对环境线索作出反应并进行整合,从而决定了它们的命运和功能。损伤诱发了干细胞
2021年11月30日讯/生物谷BIOON/---2021年11月份即将结束了,11月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:组织干细胞维持不同的表观遗传记忆机制
doi:10.1126/science.abh2444
组织干细胞对环境线索作出反应并进行整合,从而决定了它们的命运和功能。损伤诱发了干细胞微环境发生根本性变化,从而触发干细胞经历一系列精心设计的事件,包括离开原来的壁龛(niche),迁移到伤口部位,克服炎症,重新产生组织,并在新的部位居住下来。伤口也能诱发可塑性,调动干细胞来修复相关但不同的组织。目前还不清楚干细胞是否在伤口修复中积累和保留这些空间和时间上的经验记忆,如果是的话,这如何发生,后果如何。
在毛囊(HF)内,毛囊干细胞(HFSC)通常只制造毛发,但当伤口损坏覆盖毛囊的皮肤组织时,它们就会被重新利用。在一项新的研究中,来美国洛克菲勒大学的研究人员利用谱系追踪,监测HFSC在伤口修复和干细胞可塑性过程中的时间进展。在离开它们的壁龛和再生缺失的组织后,它们可以长期保持在新的表皮中,并在此后维持皮肤屏障。通过探索转录组和表观基因组的动态变化,并研究这些迁移的HFSC在新的壁龛中的行为,他们了解到这些干细胞积累了关于它们过去经历的离散表观遗传记忆,其中的每一种都以不同的方式影响整体组织功能。相关研究结果发表在2021年11月26日的Science期刊上,论文标题为“Stem cells expand potency and alter tissue fitness by accumulating diverse epigenetic memories”。
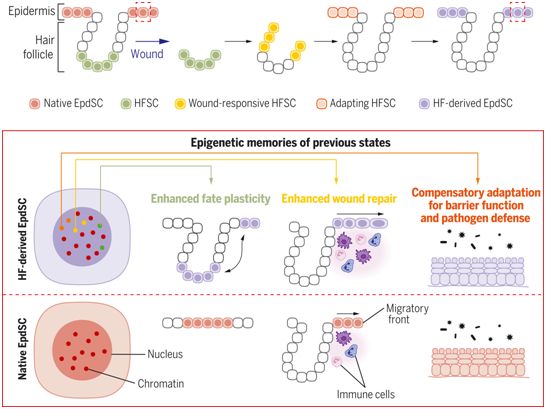
干细胞积累了它们过去经历的表观遗传记忆。图片来自Science, 2021, doi:10.1126/science.abh2444。
2.Science:揭示大脑的岛叶皮层利用身体信号来调节恐惧
doi:10.1126/science.abj8817
恐惧是生存的必要条件,但必须得到很好的调节,以避免有害的行为,如惊恐发作或过度的冒险行为。如今,在一项新的研究中,来自德国马克斯-普朗克神经生物学研究所的研究人员在小鼠身上发现,大脑依靠身体的反馈来调节恐惧。相关研究结果发表在2021年11月19日的Science期刊上,论文标题为“Fear balance is maintained by bodily feedback to the insular cortex in mice”。
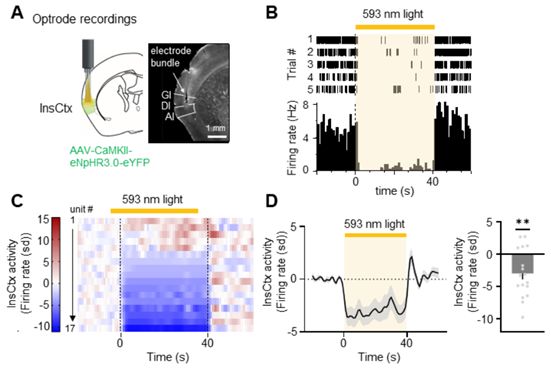
在光遗传学抑制期间InsCtx的体内电生理单单位记录。图片来自Science, 2021, doi:10.1126/science.abj8817。
为了更多地了解这个基本过程,Gogolla团队检查了具有不同恐惧水平的小鼠的岛叶皮层的活动。在恐惧程度较低的小鼠中,一旦它们接触到引起恐惧的音调,岛叶皮层的活动就会增加。相反,高度恐惧的动物在听到这种音调时显示出岛叶皮层活动的减少。令人震惊的是,Klein观察到,一旦小鼠表现出恐惧诱发的僵住行为,它的心率就会下降,岛叶皮层的活动也会下降。高度恐惧的小鼠在听到这种音调时僵住的频率和时间都大大增加,这可以解释观察到的它们的岛叶皮层的失活。
为了测试心率和岛叶皮层活动之间的联系,Gogolla团队通过迷走神经干扰了身体和大脑之间的信息流动。有趣的是,当心脏和大脑之间的交流被中断时,岛叶皮层的活动保持稳定,在僵住期间没有减少。因此,这项新的研究表明,岛叶皮层需要来自身体的反馈,以将恐惧维持在一个适当的水平。此外,它还提供证据表明,僵住期间发生的身体变化是情绪调节的一个重要部分,而且僵住远不止是一种被动的情绪反应。
3.Science:揭示宿主免疫力驱动登革热病毒进化
doi:10.1126/science.abk0058
在一项新的研究中,来自美国国家过敏与传染病研究所和佛罗里达大学等研究机构的研究人员提供了证据,表明宿主免疫力驱动了登革热病毒的进化。他们回顾性地分析了泰国二十年来的登革热病毒基因变异,以及人口层面的感染和免疫措施。相关研究结果发表在2021年11月19日的Science期刊上,论文标题为“Antigenic evolution of dengue viruses over 20 years”。
有四种类型的登革热病毒。自20世纪60年代初以来,所有四种登革热病毒都在泰国共同流行。这提供了一个研究这些登革热病毒如何相互竞争人类宿主的机会。论文第一作者、佛罗里达大学前博士后研究员Leah Katzelnick说,“我们想了解长期在一个地方流通的登革热病毒的生态和进化情况。”
这项新的研究使用了来自曼谷的1944份归档血液样本。这些样本是从已知的登革热患者身上保存下来的,它们代表了1994年至2014年间每年的所有四种登革热病毒毒株。该团队对2000多份登革热病毒样本进行了基因测序。
这些作者随后对代表每种毒株时间序列的一个较小的样本亚集进行了测试。由此,他们描述了这些毒株在不同时期相互之间的抗原关系(antigenic relationship)。抗原关系表征了对一种病毒的免疫反应对其他病毒的保护程度。
4.Science:揭示食蟹猴发育过程中的X染色体剂量补偿机制
doi:10.1126/science.abd8887
哺乳动物的性染色体是双态的,即X和Y染色体。雌性有两条X染色体,而雄性有一条X染色体和一条Y染色体。X染色体编码800多个基因;相比之下,Y染色体编码关键的雄性决定因子SRY,但一般来说它编码的基因数量较少。进化出的机制可确保X染色体和常染色体之间以及雌性和雄性之间的基因剂量平衡,即X染色体上调(XCU)和X染色体失活(XCI)。在小鼠中对XCI进行了深入研究,为染色体活动的表观遗传学调控提供了一种模式。长链非编码RNA Xist在激活X染色体上的一连串抑制事件中起着核心作用,包括组蛋白H3赖氨酸27三甲基化(H3K27me3)和组蛋白H2A赖氨酸119单泛素化(H2AK119u1),这些抑制事件在发育早期导致了XCI。然而,最近的研究发现了不同哺乳动物之间在XCI机制方面的关键分歧。在人类中,XIST对于实现XCI是不够的,而且XCI的机制仍然不清楚。
食蟹猴是与人类存在密切亲缘关系的灵长类动物。它们可以作为人类发育的适当模型,并提供有关剂量补偿机制进化的关键信息。在一项新的研究中,来自日本京都大学等研究机构的研究人员对食蟹猴早期发育和生殖细胞发育过程中的X染色体活动进行了全面表征。相关研究结果发表在2021年11月19日的Science期刊上,论文标题为“The X chromosome dosage compensation program during the development of cynomolgus monkeys”。

猴子发育过程中X染色体活动的动态变化。图片来自Science, 2021, doi:10.1126/science.abd8887。
单细胞转录组分析显示,雄性食蟹猴逐渐实现XCU,而雌性食蟹猴则与XCI同时出现XCU,这两者在植入后1周时建立了X染色体:常染色体的剂量补偿。另一方面,雌性生殖细胞在没有抑制的情况下双等位基因地表达X连锁基因,或在它们特化后重新激活,抑制两条染色体上的XIST(E13-E17),然后擦除H3K27me3(E22-E28)。此后,它们获得了完全的双等位基因X连锁基因表达和XIST重新表达(E42)。
5.Science:重大突破!因脊髓损伤而瘫痪的患者新福音!一次注射新型两亲超分子肽纤维支架在4个星期内让瘫痪的小鼠恢复行走能力
doi:10.1126/science.abh3602
在一项新的研究中,来自美国西北大学的研究人员开发出含有两种肽序列的促进神经再生的两亲超分子肽纤维支架(supramolecular peptide fibril scaffold)。单次注射这种支架可逆转脊髓损伤后的瘫痪和修复脊髓组织。他们对瘫痪小鼠的脊髓周围组织进行了一次
注射。仅仅四个星期后,这些小鼠就恢复了行走能力。相关研究结果发表在2021年11月12日的Science期刊上,论文标题为“Bioactive scaffolds with enhanced supramolecular motion promote recovery from spinal cord injury”。

脊髓,图片来自me-pedia.org。
在这种疗法发挥它的功能后,这种支架在12周内被生物降解为细胞的营养物,然后完全从体内消失,没有明显的副作用。这是第一项研究表明科学家们首次通过改变化学结构来控制这种支架中的分子的集体运动,从而提高治疗效果。
论文通讯作者、西北大学的Samuel I. Stupp说,“我们的研究旨在找到一种可以防止个人在重大创伤或疾病后瘫痪的疗法。几十年来,这一直是科学家们面临的一个重大挑战,因为我们身体的中枢神经系统,包括大脑和脊髓,在受伤后或退行性疾病发生后没有任何明显 的自我修复能力。我们将直接向美国食品药品管理局(FDA)提出申请,开始批准这种新疗法用于人类患者,因为这些患者目前的治疗选择非常少。”
6.Science:使用机械工具可以提高我们的语言技能,反之亦然
doi:10.1126/science.abe0874
我们理解复杂句子的句法的能力是最难掌握的语言技能之一。在2019年,已有研究揭示了特别精通工具使用和拥有良好的句法能力之间的相关性。在一项新的研究中,来自法国Inserm、CNRS、里昂大学和瑞典卡罗林斯卡研究所的研究人员发现这两种技能都依赖于位于同
一个大脑区域的相同的神经资源。此外,使用工具的运动训练提高了我们理解复杂句子语法的能力,反之亦然,句法训练提高了我们使用工具的熟练程度。这些发现可能能够应用于临床,以支持失去部分语言技能的患者的康复。相关研究结果发表在2021年11月12日的
Science期刊上,论文标题为“Tool use and language share syntactic processes and neural patterns in the basal ganglia”。
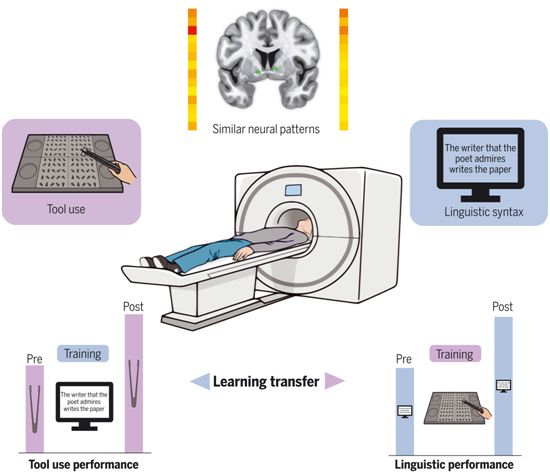
工具使用和语言共同依赖于相同的神经资源。图片来自Science, 2021, doi:10.1126/science.abe0874。
鉴于这两种技能类型使用相同的大脑资源,是否有可能通过训练一种技能来提高另一种技能?使用机械钳子的运动训练是否能提高对复杂短语的理解?在这项研究的第二部分,这些作者研究了这些问题,并表明情况确实如此。这一次,参与者被要求在用钳子进行30分钟 的运动训练之前和之后执行一项句法理解任务。通过这一点,他们证明了用这种工具进行的运动训练会导致句法理解练习的成绩提高。此外,他们的研究结果还表明,相反的情况也是如此:对语言能力的训练,以及对具有复杂结构的句子的理解练习,提高了使用这种工 具的运动表现。
7.Science:利用一种新的神经-光学系统成功地操纵记忆
doi:10.1126/science.abj9195
当一份重要的文件放在你的桌上时,你可能会把它归档保存。同样的事情也发生在我们的记忆中:情节记忆(episodic memory)最初编码在大脑的海马体中,然后在一种称为记忆巩固(memory consolidation)的过程中转移到大脑皮层进行长期储存。突触可塑性是学习
的基础,在记忆巩固中起着关键作用。然而,在很大程度上仍然不知道突触可塑性发生的地点和时间,以及它如何塑造神经元表征。
在一项新的研究中,来自日本理化学研究所(RIKEN)、京都大学、筑波大学、大阪大学和埼玉大学的研究人员通过使用小鼠的大脑展示了一种新的神经-光学系统来操纵记忆。这种技术阻碍了神经活动,即所谓的长时程增强(long-term potentiation, LTP),否则 它
将在睡眠期间巩固记忆。相关研究结果发表在2021年11月12日的Science期刊上,论文标题为“Stepwise synaptic plasticity events drive the early phase of memory consolidation”。论文通讯作者为京都大学的Yasunori Hayashi博士。论文第一作者为京都大 学
的Akihiro Goto博士。
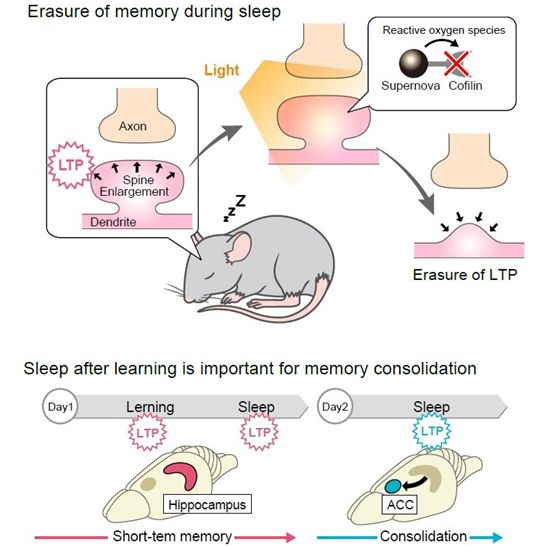
光照对小鼠大脑突触的影响,图片来自KyotoU/Akihiro Goto。
最初,给小鼠的大脑注射了通常用于基因递送的腺相关病毒(AAV),然后使之表达一种由丝切蛋白和荧光SuperNova组成的融合蛋白。当暴露在光线下时,这种蛋白释放出活性氧,使附近的丝切蛋白等化合物失活。海马体中LTP的发生是很有重要的,因为记忆最初储存在 海马体中。当大脑的这一区域被照射时,在小鼠学习一项任务后立即接受照射,然后在学习后的睡眠期间再次接受照射,记忆就会丢失。Goto评论说,“令人惊讶的是,通过有针对性的照射来消除局部LTP,明显 地消除了记忆。”
8.Science:肠道杀菌蛋白SPRR2A在肠道蠕虫感染时保护肠道屏障
doi:10.1126/science.abe6723
先前的研究已表明,编码SPRR2A(small proline-rich protein 2A, 富含脯氨酸的小蛋白2A)的基因在小鼠小肠中在共生细菌定植后高度上调。为了阐明SPRR2A在肠道中的功能,来自美国德克萨斯大学西南医学中心的研究人员在一项新的研究中探究了它的调节、作用机制、对肠道微生物群的影响以及限制致病性细菌感染的能力。当小鼠感染了肠道蠕虫(寄生虫),Sprr2a的表达进一步升高,超过了共生微生物群诱导的水平。肠道蠕虫感染极大地改变了肠道的免疫反应,并导致上皮损伤和肠道细菌对组织的入侵增加。因此,这些作者在这项新的研究中也探讨了SPR2A上调的分子基础及其在肠道蠕虫感染期间的生理作用。相关研究结果发表在2021年11月5日的Science期刊上,论文标题为“Small proline-rich protein 2A is a gut bactericidal protein deployed during helminth infection”。
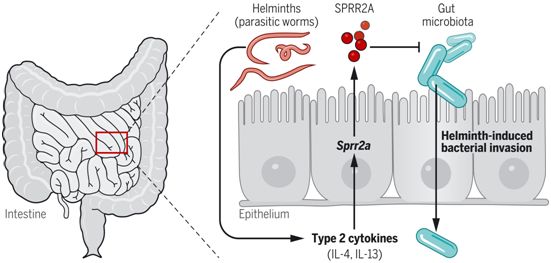
在肠道蠕虫感染时,SPRR2A保护肠道屏障。图片来自Science, 2021, doi:10.1126/science.abe6723。
这些作者进行了体外生化研究以确定SPRR2A的生物活性。纯化的重组SPRR2A在体外选择性地杀死革兰氏阳性菌,而革兰氏阴性菌对SPRR2A的杀伤力有抵抗力。SPRR2A的杀菌机制涉及与带负电荷的脂质结合并破坏细菌的细胞膜。他们培育出缺乏Sprr2a的小鼠,发现总体的 细菌载量保持不变。然而,SPRR2A的缺失导致小肠腔和粘液层中革兰氏阳性菌的扩大,这与SPRR2A在体外对革兰氏阳性菌的选择性杀菌活性相一致。Sprr2a缺乏的小鼠还表现出对单核细胞增多性李斯特菌(一种革兰氏阳性肠道病原体)感染的易感性增加。
肠道蠕虫感染可引起肠道上皮的损伤,这促进了细菌对肠道屏障的破坏,并强调了在肠道蠕虫感染期间需要AMP的表达。尽管其他AMP[比如REG3G和溶菌酶]在小鼠感染肠道蠕虫Heligmosomoides polygyrus期间显示出表达减少,但这种感染诱导的SPRR2A表达水平到高于细菌定植引起的水平。肠道蠕虫感染引起了2型细胞因子的产生,如IL-4和IL-13。SPRR2A与其他肠道AMP不同的是,它在肠道蠕虫感染期间被2型细胞因子进一步诱导。因此,肠道蠕虫感染期间Sprr2a的诱导需要STAT6,这是一种转录因子,在IL-4和IL-13的下游发挥作用,诱导2型免疫反应。最后,SPRR2A对于防止肠道细菌(主要是革兰氏阳性菌亚群)在Heligmosomoides polygyrus感染期间侵入肠道屏障是必要的。
9.Science:腺苷和GABA信号在发育期间的突触稳定中起着重要作用
doi:10.1126/science.abk2055
在发育过程中,大脑回路会经历突触形成、稳定或消除的阶段。γ-氨基丁酸(GABA)介导的突触(GABA能突触)的形成主要取决于细胞粘附分子,如神经连接蛋白(neuroligin)和富含亮氨酸的重复跨膜蛋白,它们与突触前的轴突蛋白(neurexin)和与突触前的蛋白酪氨酸磷酸酶结合的Slit-和Trk样家族蛋白相互作用。GABA和GABA A型(GABAA)受体以活动依赖的方式参与突触的成熟和修剪。三磷酸腺苷(ATP)和腺苷可以在突触处与GABA共同释放,并被腺苷A2A受体所感知。
在一项新的研究中,来自法国、葡萄牙、瑞士、西班牙和加拿大的研究人员测试了腺苷信号在稳定和消除GABA能突触中的作用。相关研究结果发表在2021年11月5日的Science期刊上,论文标题为“Convergence of adenosine and GABA signaling for synapse stabilization during development”。
A2A受体控制迁移速度、轴突伸长和树突分支。A2A受体是否控制大脑中突触的形成、稳定或消除尚不清楚。在成年大脑中,A2A受体大多表达在突触前末梢,在那里它们控制突触囊泡释放的概率。在早期大脑发育过程中,神经突触的A2A受体的数量、位置和功能一直不清楚。
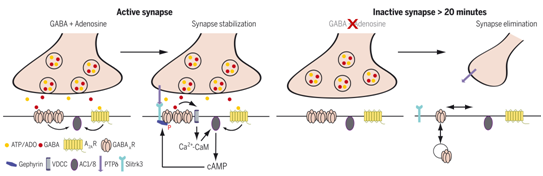
图片来自Science, 2021, doi:10.1126/science.abk2055。
A2A受体和GABAA受体的信号通路汇聚到对钙-钙调蛋白敏感的腺苷酸循环酶上,从而产生腺苷3',5'-单磷酸(cAMP)。由此产生的蛋白激酶A的激活导致突触后支架分子gephyrin在蛋白激酶A敏感的第303位点上的丝氨酸残基发生磷酸化。模拟这种磷酸化状态的gephyrin突变体的表达可以防止在去除细胞外腺苷后的突触损失。磷酸化的gephyrin可与突触后跨膜的Slit-和Trk样家族蛋白3共同免疫沉淀,后者在突触间隙(synaptic cleft)中与突触前蛋白酪氨酸磷酸酶σ结合,以便形成抑制性突触。用短发夹RNA(shRNA)方法或通过表达突变体,证明了Slit-和Trk样家族蛋白3通过腺苷信号有助于稳定GABA能突触。最后,在体内突触发生过程中拮抗A2A受体,会导致动物在发育过程中丧失GABA能突触,并在成年时出现认知障碍。
10.Science:抑制捣乱的造血干细胞制造抗炎分子,有望从根源上阻止克隆性造血引发的白血病
doi:10.1126/science.aba9304
随着年龄的增长,我们中的许多人获得了突变,导致我们的一些造血干细胞比其他的造血干细胞增殖得更快,形成它们自己独特的群体或“克隆”。这被称为克隆性造血(clonal hematopoiesis)。在某些情况下,源于单个基因改变或突变的造血干细胞的单个克隆,可以扩展到占一个人的血细胞的30%之多。如果这样的“捣乱(rogue)”克隆获得了更多的突变,它可能导致骨髓增生症(一种罕见的血液疾病),并进而导致白血病。
在一项新的研究中,美国波士顿儿童医院干细胞研究项目主任Leonard Zon博士及其团队想知道是否可以将这些捣乱细胞群体扼杀在萌芽状态,防止潜在的致命白血病的发生。如果可以的话,这可能帮助那些随着年龄增长而发生克隆性造血的成年人,以及患有各种血液疾病的儿童,如Shwachman-Diamond综合征、GATA2缺乏症或RUNX1家族性血小板疾病,其中克隆性造血可在儿童时期产生。相关研究结果发表在2021年11月5日的Science期刊上,论文标题为“Resistance to inflammation underlies enhanced fitness in clonal hematopoiesis”。
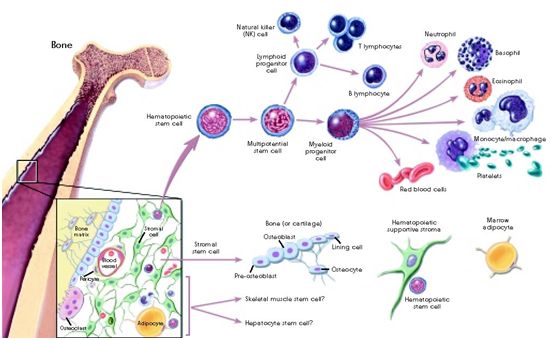
造血干细胞分化,图片来自Wikipedia。
事实上,某些突变,如基因asxl1的突变,确实导致了一个造血干细胞群体---一种单一颜色的细胞---在斑马鱼中占据主导。这些作者随后进一步研究了不同种类的血细胞会因此而开启哪些基因。携带导致克隆性造血的突变的成熟白细胞开启了一系列的炎症基因。相反,突变的造血干细胞则开启了抗炎基因,并制造抗炎分子,保护自己免受炎症影响。当他们敲除这些保护性基因之一---nr4a1---时,这种突变的造血干细胞克隆失去了适应优势,变得不那么占据主导地位。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


